
骨关节炎(OA)是常见的退行性关节疾病,严重影响患者的生活质量。近年研究表明,糖尿病是OA发病的重要危险因素,在老年糖尿病患者中OA发病率较高。因糖尿病患者体内特殊的慢性炎症微环境,使得糖尿病骨关节炎(DOA)难以有效治疗,易引发疼痛和多项功能障碍,并影响心理健康和缩短预期寿命。晚期糖基化终产物(AGEs)在DOA的发生和发展过程中发挥着关键作用,其易在关节部位积累引起软骨细胞的氧化应激、炎症反应和线粒体功能障碍,最终导致软骨的损伤和破坏。然而,目前的临床干预主要是使用镇痛剂或在关节内注射类固醇、透明质酸等药物,虽能缓解症状,但无法有效应对AGEs积累引发的慢性炎症。因此,迫切需要开发针对AGEs治疗DOA的新策略。
赵峡教授团队基于DOA的关键致病因子AGEs构建了一种具有温和光热治疗效应(mPTT)的纳米酶水凝胶(PTC-MP),通过“Restrain-Restore-Reinforce”(3R)策略显著抑制了糖尿病大鼠的软骨损伤并改善了关节的运动功能,在DOA治疗方面取得了新进展。相关研究成果以“Nanozyme-Integrated Hydrogel Targeting AGEs for Diabetic Osteoarthritis Therapy”(靶向AGEs纳米酶整合水凝胶用于糖尿病关节炎治疗)为题,发表于《Advanced Science》(IF=14.1,TOP期刊)。
团队通过将聚多巴胺修饰的单宁酸-铈纳米酶(PTC)引入由海藻酸钠(SA)、Mg2+和泊洛沙姆(P407)形成的互穿网络体系中,构建了一种可注射温敏水凝胶(PTC-MP)(图1A)。PTC-MP水凝胶联合mPTT发挥了如下作用:①PTC-MP水凝胶中的单宁酸(TA)可抑制AGEs的形成;②PTC纳米酶可减少AGEs诱导的活性氧(ROS)过度产生,恢复软骨稳态;③Mg²⁺的加入可促进透明质酸(HA)的分泌,从而改善关节润滑和增强DOA的损伤修复(图1B)。该团队还通过构建糖尿病骨关节炎模型评价了PTC-MP水凝胶在体内抑制软骨损伤的效果,结果表明PTC-MP水凝胶可有效抑制糖尿病大鼠的软骨磨损、提高胶原沉积和软骨厚度(图2),并明显改善了糖尿病大鼠的运动功能(图3)。
与以往的研究相比:尽管OA的病理机制及治疗已取得显著进展,但针对DOA这一特殊亚型的治疗研究仍十分缺乏。该研究是首次基于AGEs靶点构建纳米体系用于抗DOA的治疗,并通过三管齐下的“3R”策略有效提升了DOA治疗效果,为后续抗DOA的药物开发提供了新路径。然而,该研究亦存在一定的局限性:如评价所用的动物模型为Ⅰ型糖尿病而非常见的Ⅱ型糖尿病,纳米材料在关节腔内的长期分布、生物降解等药代动力学性质尚需进一步探究。
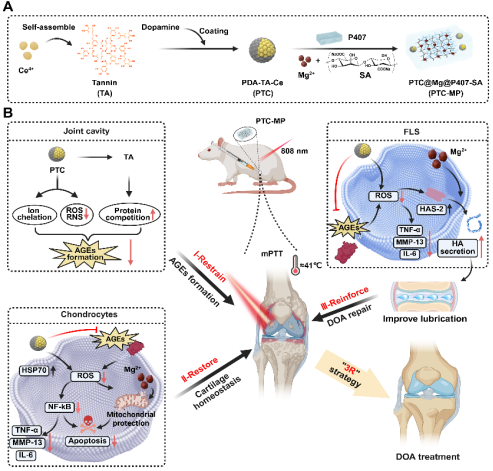
图1:基于AGEs靶向治疗的PTC-MP水凝胶治疗DOA的实验设计与机制示意图。(A)PTC-MP水凝胶制备示意图。(B)基于靶向AGEs和“3R”策略水凝胶抗DOA的机制示意图:Ⅰ-PTC-MP水凝胶通过清除自由基、螯合亚铁离子和竞争性疏水位点结合,抑制AGEs的形成;Ⅱ-PTC-MP水凝胶联合mPTT减少AGEs诱导的过度活性氧产生和线粒体功能障碍,从而恢复软骨稳态;Ⅲ-PTC-MP水凝胶通过促进内源性HA分泌和改善关节润滑,增援软骨修复。
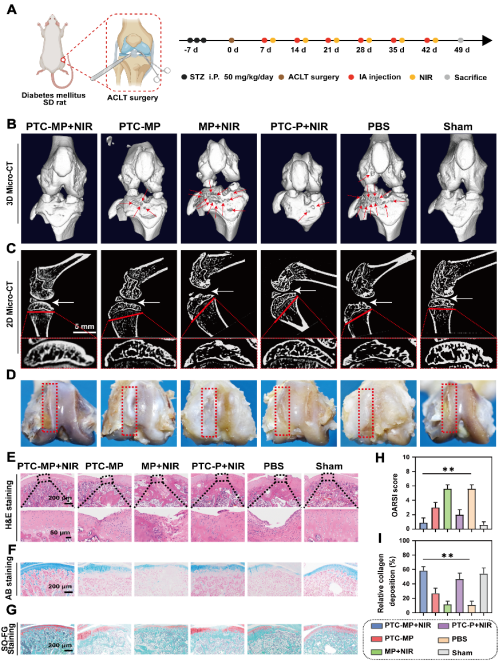
图2:PTC-MP水凝胶在mPTT作用下抗DOA的治疗效果。(A)DOA模型建立及治疗方法示意图。不同治疗组处理7周后,糖尿病大鼠膝关节(B)和软骨下骨(C)Micro-CT重建图像。(D)不同治疗组处理7周后,糖尿病大鼠膝关节软骨宏观图片。不同治疗组处理7周后,软骨切片的H&E染色(E)、阿利新蓝染色(F)和番红O染色(G)。不同治疗组处理7周后,关节软骨的OARSI评分(H)以及胶原沉积水平(I)。
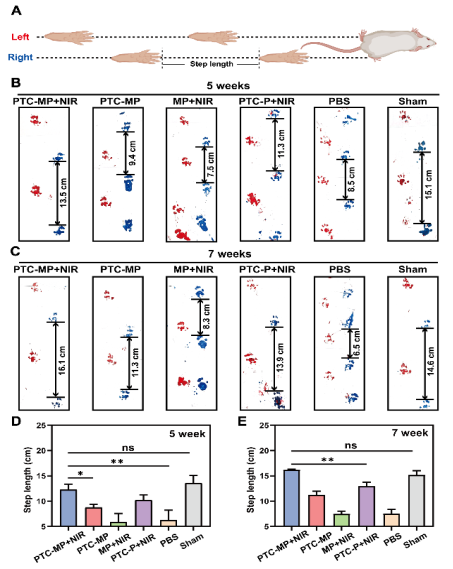
图3:DOA模型大鼠行为学实验。(A)足迹分析实验的示意图。不同治疗组处理5周(B)或7周(C)后大鼠爬行足迹。不同治疗组处理5周(D)或7周(E)后大鼠爬行足迹定量统计。
中国海洋大学医药学院2023级博士研究生陈睿为该论文第一作者,赵峡教授和韩璐教授为通讯作者。
原文链接:http://doi.org/10.1002/advs.202516389
【关闭】





