阿尔兹海默症(Alzheimer’s disease ,AD)是一种起病隐匿的、进行性发展的神经系统退行性疾病,是痴呆症的主要发病类型,目前全球约有5000万人受到痴呆症的影响,随着大多数国家预期人均寿命的延长,AD的患病率预计会逐渐上升,预计到2050年将增加到1.5亿人,为世界各国的医疗系统带来巨大压力。临床上用于AD诊断的方法有神经影像学检查、脑脊液标志物检测以及认知量表测量等。神经影像学检查需要向病人体内注射放射性示踪剂完成大脑中病理标志物的成像,放射性示踪剂对患者身体会造成很大副作用;而脑脊液标志物检测则需要通过腰椎穿刺进行患者脑脊液的提取及分析,具有很强的侵入性,患者依从性较差;认知量表的测量结果受主观因素影响较大,结果可靠性不强。由于AD的致病机理尚未被完全阐明,针对AD的上市药物主要为症状缓解类,疾病修正类药物极少,因此,阿尔兹海默症至今仍无法治愈。一个首要挑战在于该病具有漫长的临床潜伏期;待到临床症状显现时,通常已造成了严重且不可逆的神经元损伤,导致明显的记忆和功能损害。而AD临床早期生物标志物的筛查对通过早期干预策略延缓疾病、改变疾病进程甚至预防疾病至关重要。血浆181位磷酸化tau蛋白(p-tau181)在健康对照组、轻度认知功能障碍和中度AD期之间存在显著差异,是一种可信度高、侵入性小的、具有显著临床应用价值的AD早期生物标志物。近日,中国海洋大学医药学院邱雪课题组在分析化学权威期刊《Analytical Chemistry》发表了一篇题为“Homogeneous Femtomolar Detection of P-tau181 via Proximity Extension and CRISPR/Cas Technique”的研究论文,团队利用邻近延申技术(Proximity Extention Assay,PEA)将p-tau181含量信息转化为核酸信号,并通过重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)进行等温信号放大,最后联合CRISPR/Cas技术进行荧光信号输出,构建了一个无需任何洗涤步骤、操作简便的p-tau181均相超灵敏分析方法。该方法的检测限可达45.4 fM,样品用量仅为2.5 μL,且无需价格昂贵的Simoa单分子免疫分析平台;在复杂生物基质(胎牛血清和人血清)中具有优异的抗干扰能力,加样回收率稳定在93%-97% 之间,展现出良好的临床应用潜力;对阿尔兹海默症相关蛋白如Aβ、Aβ 寡聚体、α-突触核蛋白及总tau 蛋白均无交叉反应,特异性突出。此外该方法可拓展应用至tau蛋白的其它磷酸化位点如p-tau217和p-tau231 等的检测,为阿尔兹海默症的早期无创筛查提供了新技术新方法,目前正在与企业对接技术转化事宜。
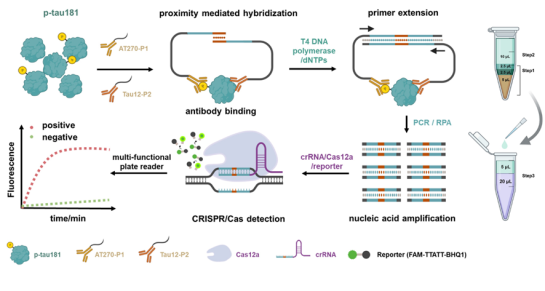
图1. 基于PEA–RPA–CRISPR/Cas技术的p-tau181检测原理与分析流程示意图
这项工作是在最新的邻近化学理论的指导下,将蛋白特异性识别抗体与核酸分子进行共价偶联,实现了均相分析体系中特定的蛋白信号向核酸信号的精准转化,同时通过有效整合核酸扩增领域的迭代技术,成功突破了蛋白均相检测中灵敏度低等技术瓶颈。
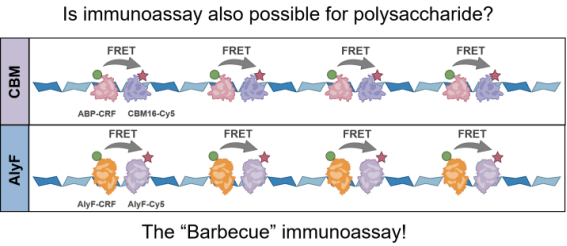
图2 基于AlyF和CBM和时间分辨FRET的海藻酸钠检测原理示意图
蛋白和核酸生物传感领域的快速发展得益于高特异性的分子识别体系(如针对蛋白的特异性抗体或核酸适配体以及针对核酸的互补杂交序列)。糖类物质作为生物体内另一类至关重要的生物大分子,其研究发展却受到多重制约。这既源于其自身缺乏模板编码机制和高度复杂的结构,也受限于现有的鉴定、解析与定量技术。目前,特异性糖分子识别主要依赖凝集素与有限的糖特异性抗体,这一局限严重制约了相关生物传感策略在糖生物学中的广泛应用。针对以上问题,邱雪团队与中国海洋大学食品科学与工程学院常耀光教授团队和海洋生命学院律倩倩副教授合作,挖掘和利用自然界在长期进化中已经存在的碳水化合物活性酶(carbohydrate-active enzymes, CAZymes)或其糖结合模块(carbohydrate-binding modules, CBMs)作为多糖的高特异性识别元件,创新性地结合时间分辨荧光共振能量转移技术(TR-FRET),实现了多糖的均相“类免疫”荧光分析,研究成果以“Time-Resolved ‘Barbecue’ Förster Resonance Energy Transfer for Sensitive and Homogenous Detection of Alginate”为题发表在《Analytical Chemistry》。团队以海藻酸钠为待测多糖模型分子,利用催化失活的海藻酸裂解酶(AlyF)或其碳水化合物结合模块对海藻酸钠的高特异识别特性,分别对其标记FRET供受体制备海藻酸钠荧光探针,该探针以新式的“烤串”结构随机结合在具有线性重复骨架的海藻酸钠分子上。在适当的探针/海藻酸钠浓度比例下,FRET供受体距离接近并产生FRET信号。本研究采用镧系配合物作为荧光供体,利用其长寿命发光特性有效滤除生物样本中短寿命背景荧光干扰。相较于传统多糖分析方法的复杂前处理流程与检测时长,该方法仅需将待测样品与探针共孵育,无需任何洗涤步骤,30分钟即可完成检测,检测限低至0.4 ng·mL⁻¹。方法在复杂生物样本基质(如胎牛血清、乳制品、护肤品)中检测性能优异,具有良好的抗干扰能力和实际应用潜力。至此,研究团队建立了蛋白、核酸及多糖等生物大分子的系统性分析平台,通过模块化FRET探针设计与信号转导机制融合创新,实现了跨分子类别的均相FRET荧光定量检测。团队未来将继续拓展糖特异性识别元件的开发和应用,通过偶联邻近化学信号转导机制和核酸扩增技术进一步提高糖类物质检测的灵敏度,推动其体内痕量分析技术的发展。
中国海洋大学医药学院为以上工作的第一通讯单位,邱雪教授为第一篇工作的通讯作者,医药学院博士研究生刘欢(已毕业)为论文第一作者;邱雪教授、常耀光教授为第二篇工作的共同通讯作者,医药学院博士研究生张安然、食品科学与工程学院博士研究生梅轩玮(已毕业)、律倩倩副教授为论文共同第一作者。两项工作得到了山东省泰山学者青年专家项目、山东省优青、国家自然基金青年科学基金、中国海洋大学关键核心技术项目和青岛海洋科技中心科技创新项目等项目的资助。
论文链接:
DOI:10.1021/acs.analchem.5c03101
DOI:10.1021/acs.analchem.5c04856
【关闭】





