近日,中国海洋大学医药学院、海洋药物教育部重点实验室邵长伦教授课题组,在海洋来源抗结核药物开发领域取得重要进展,相关研究成果以“Discovery of Unprecedented Arylation Coupling Cyclopeptide Inspires Natural Product-like Antitubercular Lead Compounds”(《前所未有的芳基偶联环肽启发天然产物类抗结核先导分子的发现》)为题发表在国际知名期刊JACS Au(10.1021/jacsau.5c00915)上。
图1. 天然产物灵感下抗结核候选药物的研发
在versicomycin新颖骨架灵感启发下,研究团队设计并合成构建了一个环七肽化合物库,重点探索色氨酸吲哚环C-2位不同结构芳基取代及环肽骨架氨基酸残基对活性的影响。通过海分枝杆菌(Mycobacterium marinum)替代模型(与结核分枝杆菌基因组同源性高,培养周期短,病理特征类似),对该类化合物的抗结核活性、构效关系(SAR)、构象效应以及体外和体内抗菌效果进行了系统评价。
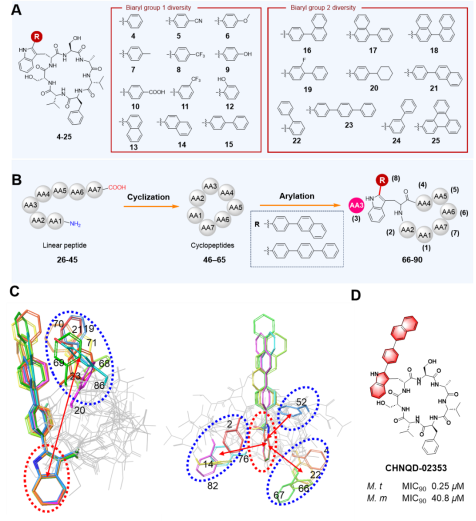
图2. Versicomycin类环肽库的构建与构象效应研究
候选药物CHNQD-02353对结核分枝杆菌H37Ra的MIC90值达0.25 μM,是versicomycin的300倍,且对其他病原体无显著抑制(选择性强,降低耐药风险)。构效关系研究发现:色氨酸残基吲哚环C-2位芳基偶联是活性关键;活性化合物具有“刚性药效团-柔性大环”结构;空间结构上色氨酸吲哚环与苯丙氨酸苯环的空间分离构象是重要因素。体外实验表明,CHNQD-02353具有良好的生物相容性,并且与主要的一线药物具有协同作用,这表明其在临床应用方面具有广阔的可能性。在小鼠皮下感染模型实验中,该化合物能够有效减少感染小鼠病灶的细菌数量,TNF-α、IL-1β等炎症因子数量显著降低,效果优于一线药物异烟肼。这表明它是一种有前景的治疗结核杆菌感染的候选化合物。
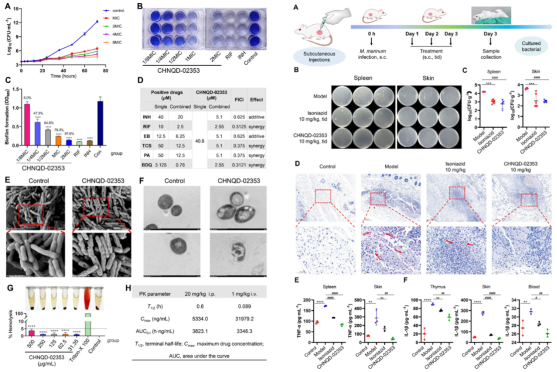
图3. CHNQD-02353的生物相容性及体内外抗菌效果
中国海洋大学为第一完成单位,邵长伦教授和魏美燕副教授为共同通讯作者,医药学院博士生张群、博士毕业生徐伟锋和博士生荆倩倩为共同第一作者,韩镒谦、武艳伟以及顾玉诚教授为文章共同作者。相关工作得到国家自然科学基金、崂山实验室自由探索项目、中央高校基本科研业务费和英国先正达国际博士生奖学金等项目的资助。
文章链接:
https://doi.org/10.1021/jacsau.5c00915
【关闭】





