【韩璐课题组】开发靶向纳米马达递送系统协同治疗类风湿性关节炎
类风湿性关节炎(RA)是一种慢性自身免疫性疾病,表现为滑膜炎症和进行性软骨破坏。由于缺氧微环境,RA患者的巨噬细胞中缺氧诱导因子1-α(HIF-1α)上调,导致活性氧(ROS)过度积累,推动促炎M1型巨噬细胞极化,加剧炎症和软骨损伤。同时,过量的ROS会诱发线粒体功能障碍,进一步恶化氧化应激反应,加速软骨破坏。此外,破骨细胞的过度激活还会加剧关节退化,形成恶性循环。因此,如何有效清除ROS、调控M1/M2巨噬细胞极化、抑制破骨细胞活化,成为RA治疗的关键挑战。
针对上述难题,韩璐教授开发了一种H2O2驱动的靶向纳米马达(Rapa-FMn@PMS),可精准递送雷帕霉素(Rapa)至M1巨噬细胞,实现了炎症部位精准给药、活性氧清除、免疫调节与软骨再生的协同治疗。在载体设计上,研究团队采用仿贻贝聚多巴胺改性介孔二氧化硅纳米颗粒(PMS)作为雷帕霉素(Rapa)载体,通过原位生长二氧化锰(MnO2)纳米酶并修饰叶酸靶向基团,构建了兼具ROS响应运动和靶向药物递送功能的纳米马达递药系统(Rapa-FMn@PMS)。
在功能机制方面,FMn@PMS纳米马达展现出了多重协同治疗效果。首先,该纳米马达通过其表面邻苯二酚基团实现了关节内长效滞留与粘附。其次,MnO2纳米酶具备超氧化物歧化酶和过氧化氢酶模拟活性,通过清除滑膜微环境中过量ROS缓解氧化应激;其次,纳米马达释放的Rapa通过激活细胞自噬途径选择性清除功能异常的线粒体,促进M1向M2表型转化,重塑炎症微环境;更进一步,纳米马达降解产物SiO44-和Mn2+离子协同抑制破骨细胞分化并促进软骨再生,实现关节组织的功能性修复。该研究不仅为关节炎治疗提供了新型纳米递药策略,其仿生材料设计理念和多重功能协同机制更为其他炎症性疾病的纳米治疗提供了重要参考。

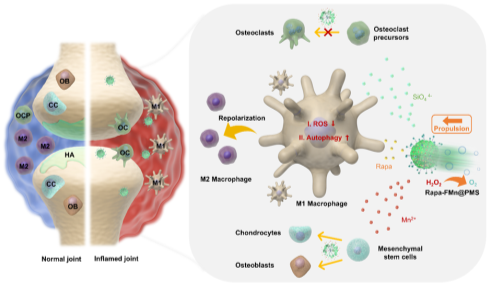
图1.用于雷帕霉素靶向递送的H2O2驱动纳米马达的设计与RA协同治疗机制
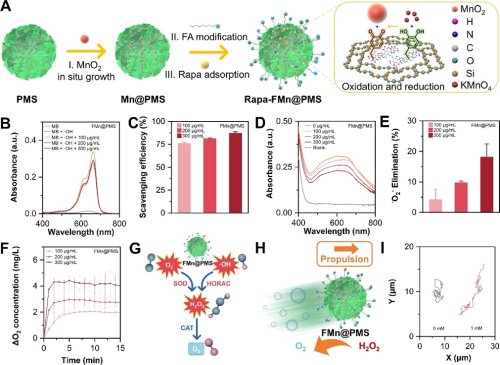
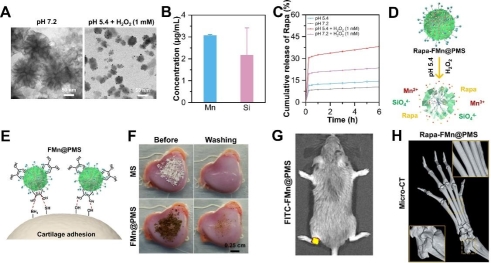
图2.(A)纳米马达制备示意图,通过溶胶-凝胶法合成聚多巴胺杂化介孔二氧化硅骨架,介导MnO2纳米酶原位生长,负载雷帕霉素,通过叶酸靶向分子偶联制备Rapa-FMn@PMS,(B-F) 纳米马达的多重类酶活性,(H-I) 纳米马达催化分解H2O2产生O2气泡推动纳米马达运动。
图3.(A-B) 纳米马达响应性降解,(C-D)纳米马达可控药物释放药物释放,(E-F) 纳米马达通过邻苯二酚基团实现特异性软骨粘附在软骨粘附,(G) 体内荧光成像显示纳米马达在关节腔长效驻留,(D)通过抗原诱导关节炎模型对纳米马达的治疗效果评估。
研究成果发表于国际知名期刊《ACS Nano》(中科院一区,Top期刊,影响因子15.8)。中国海洋大学医药学院为第一通讯单位,韩璐教授为论文唯一通讯作者,博士研究生马浩华为第一作者。该研究获得了山东省优秀青年学者自然科学基金、山东省高等教育机构青年创新团队以及高校基础研究专项经费等项目资助。论文题目为"Mesoporous silica-based nanomotors loaded with rapamycin for synergistic treatment of rheumatoid arthritis"
文章连接:https://doi.org/10.1021/acsnano.5c01763
【关闭】