近期,中国海洋大学医药学院赵峡教授团队基于自噬和胞葬抑制构建了一种共递送水凝胶(CCFA@Gel),通过设计程序化“暴露-保留-呈递”的“癌症疫苗工厂”策略,显著抑制了原发性肿瘤和肿瘤的转移,在肿瘤疫苗和免疫治疗方面取得了新进展。相关研究成果以“A cancer vaccine factory based on autophagy and efferocytosis to enhance tumor immunotherapy(基于自噬和胞葬增强肿瘤免疫治疗的癌症疫苗工厂)”为题,发表于《Chemical Engineering Journal》(IF=13.2,TOP期刊)。
癌症疫苗是一种基于肿瘤抗原激活特异性免疫反应的策略杀死肿瘤细胞,在肿瘤治疗中具有广阔的应用前景。“原位癌症疫苗”是直接利用体内肿瘤相关抗原(TAAs)触发免疫反应,与传统癌症疫苗相比具有明显的优势。但原位癌症疫苗的开发面临两大挑战:一是肿瘤细胞可通过“自噬”作用降解TAAs,减少其在病灶内的暴露和滞留;二是抗原呈递细胞(APCs)可通过“胞葬”作用清除TAAs,降低抗原的有效呈递。因此,开发新型的原位疫苗策略对癌症治疗具有重要意义。
基于此,赵峡教授团队提出了一种“癌症疫苗工厂”策略,通过以岩藻聚糖(Fuc)为载体包覆光敏剂二氢卟吩e6(Ce6)与自噬抑制剂氯喹(CQ)自组装形成的纳米粒(CCF),再与胞葬抑制剂夹竹桃素(APO)和泊洛沙姆407(P407)构建了一种可注射温敏水凝胶(CCFA@Gel)(图 1A)。该水凝胶CCFA@Gel通过一种程序化的“暴露-保留-呈递”机制发挥作用:①水凝胶靶向肿瘤细胞后在660 nm激光照射下,通过Ce6诱导免疫原性细胞死亡(ICD)实现TAAs的暴露;②通过CQ抑制自噬延长TAAs的滞留;③通过APO阻断胞葬促进TAAs的高效呈递。三者协同作用有效增强了抗肿瘤免疫应答(图 1B)。
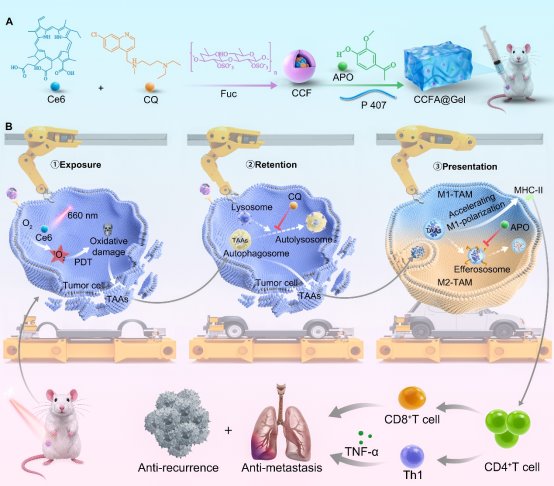
图1:基于“暴露-保留-呈递”的原位疫苗工厂策略增强肿瘤免疫治疗。(A)CCFA@Gel的制备流程。(B)原位疫苗增强抗肿瘤免疫反应的示意图:1)通过PDT原位“暴露”TAAs;2)通过抑制自噬有效“滞留”TAAs;3)通过抑制胞葬作用和促进巨噬细胞M1极化来“呈递”TAAs。
该团队通过构建原位乳腺癌模型评价了CCFA@Gel的体内抗肿瘤效果(图2),结果表明CCFA@Gel可显著抑制原位乳腺癌的生长。通过构建术后肿瘤复发小鼠模型和肺转移模型评价,结果表明CCFA@Gel可明显抑制肿瘤的复发和转移。更重要的是,CCFA@Gel诱导的原位癌症疫苗作用无需其他免疫佐剂或检查点抑制剂,展现出了良好的临床转化潜力。
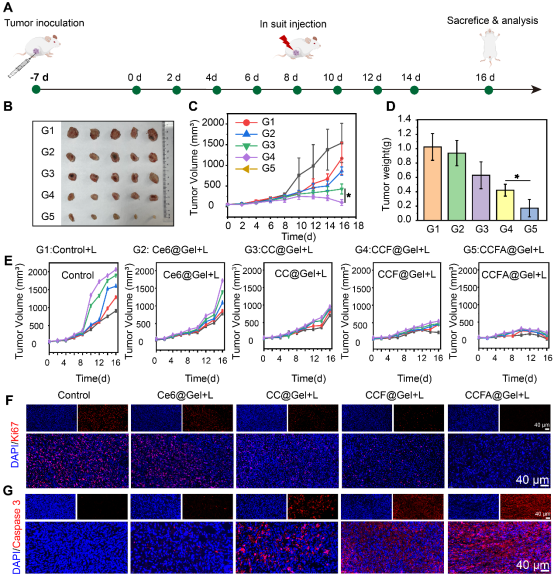
图2:CCFA@Gel+L的体内抗肿瘤作用。(A)小鼠体内治疗示意图。(B)治疗结束时不同组小鼠肿瘤的照片。(C)不同治疗组小鼠的肿瘤体积变化。(D)不同治疗组小鼠的最终肿瘤重量。(E)不同治疗组的个体肿瘤生长曲线。(F)治疗结束时肿瘤切片的Ki67表达(红色荧光)。(G)治疗结束时凋亡蛋白Caspase 3在肿瘤组织中的表达。
中国海洋大学医药学院2023级硕士研究生王羽、2021级博士研究生王腾为该论文第一作者,赵峡教授为通讯作者。
原文链接:https://doi.org/10.1016/j.cej.2025.164943
【关闭】






