近日,中国海洋大学医药学院姜帅教授团队联合德国马普高分子所Katharina Landfester教授,在国际期刊Science Advances发表题为“Integrating incompatible tandem photobiocatalysis in artificial cells enables metabolic modulation of natural cells”(在人工细胞中整合不相容的光-生物级联催化实现对天然细胞代谢的调控)的最新研究成果。
近年来,研究人员已开发出多种模拟天然细胞结构与复杂生命过程的仿生系统,包括基于脂质体、聚合物囊泡、水凝胶以及液液相分离凝聚体构建的人工细胞和人工细胞器。然而,在这些系统中高效维持生物催化反应仍面临重大挑战,其核心问题之一在于如何持续再生和供应辅酶,这也是活细胞维持生物功能的基础。尤其是氧化型辅酶NAD⁺(β-烟酰胺腺嘌呤二核苷酸)和NADP⁺(β-烟酰胺腺嘌呤二核苷酸磷酸)在生物体内发挥着关键作用,常作为脱氢酶催化底物转化的重要电子受体。尽管近年来在酶法、化学法、酶化学协同法及电化学等辅因子再生策略方面取得了诸多进展,但因组分复杂、反应条件与生物系统不兼容以及有机溶剂的使用等原因,导致其在生物系统中的实际应用仍面临重要挑战。
可见光光催化作为一种在温和条件下选择性催化反应的方法,显示出在合成生物系统中用于辅因子再生的巨大潜力。将光催化与生物催化相结合,有望突破传统难以实现的反应路径。然而,光催化过程中产生的活性氧(ROS)会导致酶失活,造成兼容性问题,限制了光-生物催化反应的拓展应用。为避免酶因暴露于ROS而失活,需将光催化剂与酶在空间上进行物理分隔,构建类似亚细胞分区的结构,从而利用ROS寿命极短的特性,在其扩散至酶作用区域之前将其转化为无害状态。学校研究团队设计了具有亚细胞分区结构的人工细胞。该体系将两种不兼容的催化模块(光催化辅因子再生系统与生物催化酒精代谢系统),分别封装于独立的人工纳米细胞器内。通过这种层级化分区策略,人工细胞实现了纳米细胞器之间的亚细胞级协同与信号传递,同时有效避免了模块间的相互干扰。该光-生物催化人工细胞与肝细胞共培养时,表现出优异的生物相容性,并在体外实验中显著缓解了酒精及乙醛引起的肝细胞氧化应激。研究结果证实可以将不兼容的光-酶催化过程在人工细胞空间内高效可控整合,实现对天然细胞代谢的有效调控。该策略不仅为设计新型化学转化过程提供了新思路,也拓展了人工细胞在化学合成、合成生物学及生物医学等领域的应用前景。
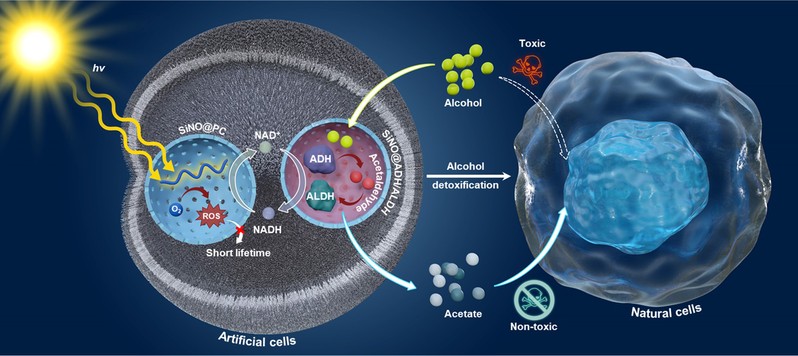
图1 人工细胞调节天然细胞代谢示意图
德国马普高分子所为该论文的第一单位,中国海洋大学医药学院姜帅教授和马普高分子所Katharina Landfester教授为共同通讯作者,马普-海大联合培养博士生王志成(海大硕士毕业生)为第一作者,相关工作得到了国家自然科学基金、山东省自然科学基金等项目的支持。
文章链接:https://www.science.org/doi/10.1126/sciadv.adu4828
【关闭】





