
肿瘤疫苗是一种可以引发肿瘤抗原特异性反应的“特种兵”,在肿瘤免疫治疗中发挥着重要的作用。然而,狡猾的肿瘤组织却布下了两道坚固的防线,企图阻挠“特种兵”的英勇冲锋。第一道防线是肿瘤细胞的“隐身术”:当免疫系统为抗肿瘤大业“冲锋陷阵”时,肿瘤细胞竟玩起了“躲猫猫”,利用自噬机制将暴露的抗原信息吞噬,让“特种兵”难以有效激活免疫反应。第二道防线是肿瘤细胞的“迷雾阵”:肿瘤微环境中的M2型巨噬细胞竟然扮演免疫“叛军”,束缚“特种兵”施展拳脚,让免疫攻击陷入困境。
近期,赵峡课题组开发了一种既可抑制自噬又可将M2极化为M1巨噬细胞的光动力原位疫苗,可直击肿瘤组织的双重防线。通过将光敏剂二氢卟吩e6(Ce6)和自噬抑制剂氯喹(CQ)进行自组装形成纳米药物(CC),再将岩藻聚糖(Fuc)与CC共负载制备成“原位疫苗”水凝胶(CCFG)(图1)。Ce6作为“先头部队”在激光照射下诱导肿瘤免疫原性细胞死亡,形成可引发特异免疫反应的“原位疫苗”。Fuc通过将M2极化为M1巨噬细胞,有效增强了肿瘤抗原的呈递;CQ则通过抑制肿瘤的自噬,进一步增强了肿瘤抗原的暴露,实现了肿瘤“原位疫苗”的双重增强,有效增强了肿瘤的免疫治疗效果。
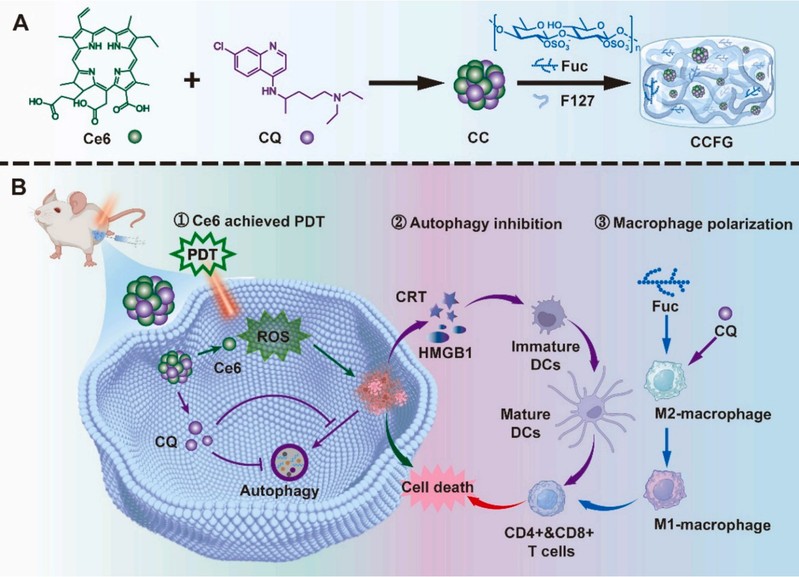
图 1:CCFG 作为原位疫苗的示意图:(A) CCFG 的制备;(B) CCFG 作为原位疫苗通过 3 个步骤抑制肿瘤:(1) Ce6 通过产生 ROS 实现 PDT,(2) CQ 通过抑制自噬增强 ICD 效果,(3) Fuc 通过 M1 巨噬细胞极化增强 APC 的抗原递呈
通过建立4T1荷瘤模型评估了CCFG的体内抗肿瘤作用(图2A)。CCFG加光照组(CCFG+L)显示出更强的抗肿瘤效果(图2B),这表明自噬抑制和M1巨噬细胞极化策略相联合,有效增强了Ce6诱发的免疫原性细胞死亡。在治疗期间小鼠体重无明显变化(图2C),表明CCFG具有良好的安全性。

图 2:对 4T1 乳腺肿瘤的体内抗肿瘤活性。(A) 不同制剂的治疗流程图;(B) 不同治疗后的肿瘤图像;(C) 用不同制剂治疗小鼠 13 天内的体重变化;(D) 不同制剂治疗后小鼠肿瘤体积的变化;(E-H) 不同组别的肿瘤生长曲线;(I) 治疗后第 13 天肿瘤切片的 Tunel 染色图像,凋亡细胞用绿色标记;(J) 治疗后第 13 天肿瘤切片的 Ki67 表达(红色荧光);(K) 第 13 天的最终平均肿瘤重量;(L) Ki67的相对表达;(M) Tunel的相对表达;(N) 不同时间小鼠的 CCFG 生物分布图像
另外,还通过建立肿瘤转移模型(图3A)和复发模型(图3C),评价了原位疫苗CCFG的抗肿瘤转移和复发效果。结果表明,CCFG可显著抑制肿瘤的肺转移和肿瘤复发。CCFG+L诱导的树突状细胞成熟(CD86+/CD80+)和效应记忆T细胞(CD62L-/CD44+)的比例明显高于对照组,表明CCFG+L建立了强大的免疫记忆,可有效抑制肿瘤的转移和复发。

图 3:体内免疫抗肿瘤活性。(A) 肺转移模型的治疗方案示意图;(B) 肺组织的 H&E 图像; (C)复发小鼠模型的治疗方案示意图;(D) 治疗后肿瘤体积增长曲线;(E) 第17天的最终平均肿瘤重量;(F)不同治疗组的脾脏记忆T细胞比例变化;(G) 不同治疗组淋巴结中 DCs 的成熟情况;(H) 复发肿瘤中 CD4+和CD8+T细胞的渗透率
相关成果以“Fucoidan based Ce6-chloroquine self-assembled hydrogel as in situ vaccines to enhance tumor immunotherapy by autophagy inhibition and macrophage polarization”为题近日发表于《Carbohydrate Polymers》(IF=10.7,TOP期刊)。中国海洋大学医药学院2021级药剂学博士研究生王腾为该论文的第一作者,赵峡教授为通讯作者。
原文链接:https://doi.org/10.1016/j.carbpol.2024.122637
【关闭】





