近日,中国海洋大学医药学院、海洋药物教育部重点实验室李德海教授团队在国际顶尖期刊Advanced Science发表题为《Exploring the Diverse Landscape of Fungal Cytochrome P450-Catalyzed Regio- and Stereoselective Dimerization of Diketopiperazines(真菌细胞色素 P450区域和立体选择性催化二酮哌嗪多样化二聚的全面探索研究)》的最新研究进展(DOI: 10.1002/advs.202310018)。
二聚吲哚二酮哌嗪(dimeric indole-containing diketopiperazine,di-DKP)由两分子二酮哌嗪(diketopiperazine,DKP)单体通过C-C或者C-N键偶联形成,是广泛存在于细菌和真菌中的生物碱。该类化合物具有多样的生物活性,但其立体选择性的化学合成依然存在巨大的挑战。在di-DKP生物合成过程中,存在多种区域及立体选择性的二聚化模式(图1),极大丰富了di-DKPs的结构多样性。虽然已报道的di-DKPs绝大多数来源于真菌,但目前二聚化的机制研究多基于细菌,关于真菌催化关键二聚化反应的酶仅有一例报道。因此,鉴定真菌的DKP二聚化酶不仅能够揭示di-DKPs多样性的基础,也有助于理解二聚化反应的区域及立体选择性。

图1. 二聚化方式构成了di-DKPs化学多样性的基础
研究人员首先以报道的真菌DKP二聚化酶为靶点,通过blast及SSN分析构建了真菌P450的序列相似性网络,揭示了一类可能专一负责二聚化反应的P450酶。其中有20个P450与一个双模块的非核糖体肽合成酶(nonribosomal peptide synthetase,NRPS)在基因簇上是连锁的,推测可能负责di-DKPs的生物合成。将假定的DKP二聚化P450酶进行进一步的进化树分析,结果显示这些P450分为三支,可能负责催化不同二聚化模式的生成。为了确认这一假设,研究人员分别从三个分支中选取了5个基因簇在模式菌株构巢曲霉中进行了异源表达,结果显示:Clade I(AmiP450)负责催化C3-C3' (2S,3S,2'S,3'S)连接的生成;Clade II(AcrP450)负责催化C3-C3' (2R,3R,2'R,3'R)连接的生成;Clade III(AtP450,AcP450,AtuP450)主要负责催化非对称型二聚化方式的形成(图2)。以上研究通过基因挖掘鉴定了5个区域及立体选择性不同的P450二聚化酶,包括8种连接方式,其中有2种为新的连接方式(C3R-C3′R, C3R- C8′),另外6种与细菌共有;并首次报道了催化含D型氨基酸DKP为天然底物的P450酶(AcrP450和AtuP450);同时分离鉴定了5个新的di-DKP生物碱(3a, 4a, 8a, 9a, 11d)和2个之前是细菌 (11b, 11c)途径来源的产物。这些结果表明了P450催化二聚化模式与其在进化树的分支是一致的。为进一步拓展di-DKP的结构多样性,利用组合生物合成构建了五个基因簇的非天然表达途径,分离到了9个与天然途径不同的二聚体,其中有5个为新化合物(4b, 7b, 8b, 9b, 15c)、2个之前仅从细菌(14e)或者化学合成(14c)途径获得(图3);同时揭示了P450催化DKP二聚化的模式也受到底物的影响。
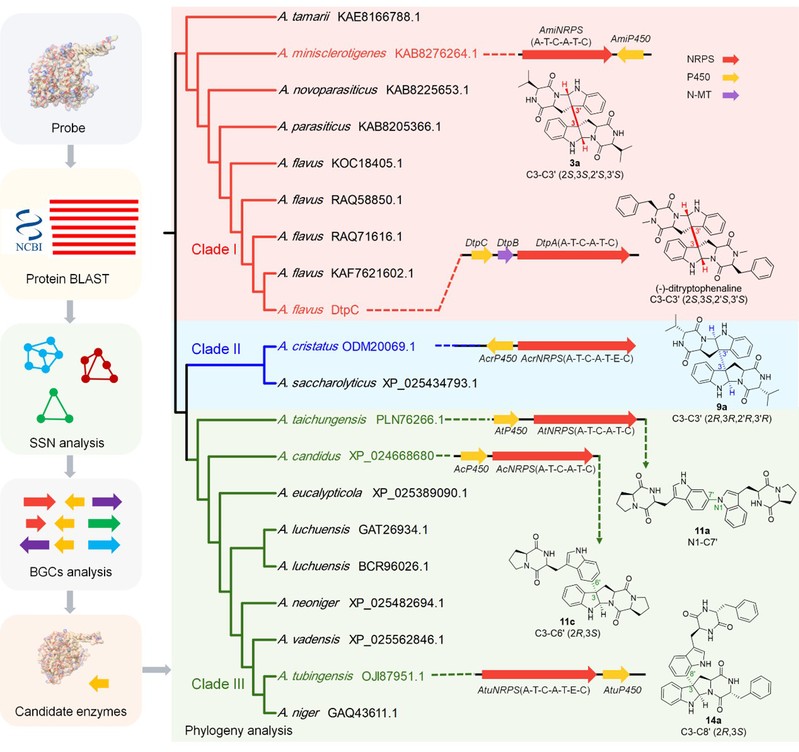
图2. 真菌负责DKP二聚化P450的生物信息学分析及对应的二聚化模式

图3.利用组合生物合成拓展di-DKP的结构多样性(红色为新化合物)
之后研究人员通过序列比对、蛋白质建模及序列替换实验鉴定了AtuP450中C端的一段区域控制了AtuP450催化反应的区域选择性,并利用分子对接解释了其选择性改变的机理(图4)。综上所述,本研究揭示了多变的P450是真菌产生结构多样的di-DKPs的基础,并加深了我们对于P450酶催化反应的区域及立体选择性的理解,为进一步改造及应用提供了新的见解。
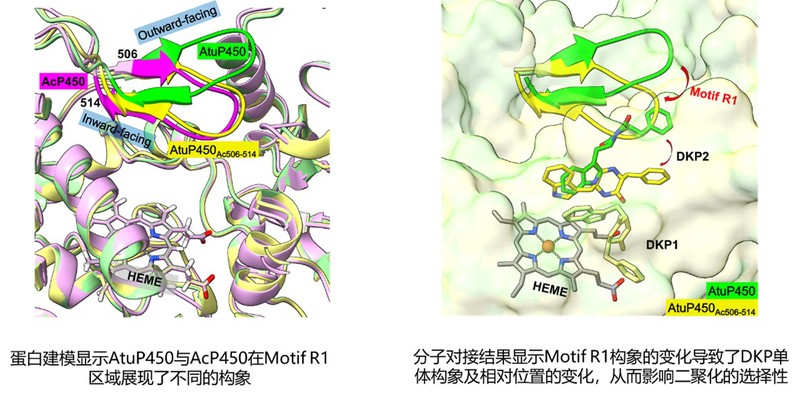
图4.区域Residues506-514(motif R1)控制AtuP450选择性的基础
中国海洋大学为第一通讯单位,李德海教授为通讯作者,医药学院毕业博士研究生马传腾与博士后王文雪为并列第一作者,张开金、张发雷、常一民、孙春晓以及车茜副教授、朱天骄教授、张国建教授为文章共同作者。该工作得到国家自然科学基金、青岛海洋科技中心科技创新项目、三亚崖州湾科技城海南省联合项目、山东省泰山学者青年专家项目和山东省自然科学基金重大基础研究项目的资助。
文章链接:https://doi.org/10.1002/advs.202310018
【关闭】





