
细胞焦亡与传统细胞程序性死亡方式—凋亡不同,可以使肿瘤细胞发生“爆炸”彻底释放自身所有相关抗原,从而使肿瘤在免疫系统面前处于一种“暴露”状态,是抗癌阵营中的一支新式武器。然而,肿瘤免疫抑制微环境具有强大的防御力量,会限制细胞焦亡释放的肿瘤相关“情报”向免疫系统呈递,并抑制免疫“攻击部队”细胞毒性T淋巴细胞(CTLs)向肿瘤的渗透。
近日,医药学院赵峡教授课题组结合基于透明质酸(HA)紫杉醇(PTX)前药与免疫系统的“传令兵”锰离子(Mn2+),设计了一种新型复合纳米粒(Mn-HSP)。Mn-HSP一方面可通过细胞焦亡暴露肿瘤“情报”,另一方面可通过“传令兵”Mn2+介导的干扰素刺激基因(STING)通路打开肿瘤防御缺口,协助“情报”传递并促进“攻击部队”向肿瘤渗透,进而明显抑制了肿瘤的复发及转移。相关成果以“Circulating immunotherapy strategy based on pyroptosis and STING pathway: Mn-loaded paclitaxel prodrug nanoplatform against tumor progression and metastasis”为题,发表于《Biomaterials》(IF=14.0)。中国海洋大学医药学院2020级博士研究生王炳杰为该论文第一作者,赵峡教授为通讯作者。
该研究将亲水性HA通过谷胱甘肽(GSH)响应键与疏水性PTX连接,获得前药胶束(HSP)并进一步负载Mn2+形成复合纳米粒(Mn-HSP)。HA可与肿瘤细胞表面过表达的CD44受体特异性结合,促进肿瘤细胞对Mn-HSP的摄取。PTX可以通过诱导肿瘤细胞焦亡释放肿瘤相关抗原,增强肿瘤免疫原性,启动抗肿瘤适应性免疫。Mn2+可通过激活STING通路释放I型干扰素(IFNs)激活先天性免疫,增强树突状细胞(DCs)抗原的呈递能力以及CTLs的肿瘤浸润,从而实现有效的抗肿瘤免疫治疗(图1)。
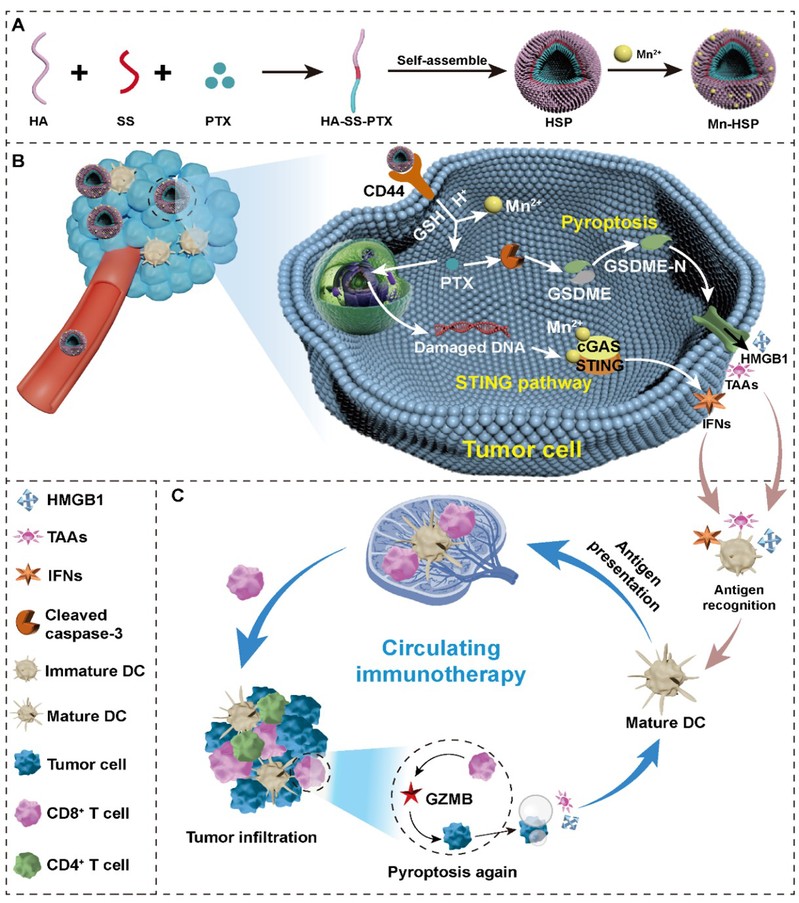
图1:Mn-HSP抗肿瘤示意图。(A)Mn-HSP的制备。(B)Mn-HSP诱导焦亡释放肿瘤相关抗原,并通过Mn2+激活STING通路释放IFNs。(C)Mn-HSP促进DCs抗原提呈和CTLs的肿瘤浸润,形成循环免疫增强抗肿瘤免疫疗效。
为了评估Mn-HSP的肿瘤靶向能力,该团队将香豆素-6(Cou-6)或细胞膜荧光染料(DiR)作为荧光示踪信号,加载到Mn-HSP中(Mn-HSP@Cou-6或Mn-HSP@DiR)。结果表明,Mn-HSP@Cou-6处理的4T1细胞显示出更高的细胞摄取(图2 A, B),Mn-HSP@DiR可更有效地富集于肿瘤部位(图2 G),证明Mn-HSP具有更好的肿瘤细胞摄取和肿瘤组织靶向递送能力。
体外机制研究表明,Mn-HSP可以显著促进肿瘤细胞“冒泡”(图2 C),并降低caspase 3和GSDME水平,升高cleaved caspase 3和GSDME-N水平(图2 D, E),证明其可有效诱导肿瘤细胞的焦亡。同时,Mn-HSP可以明显促进肿瘤细胞表达IFN-β(图2 F),证明其可以有效激活STING通路。

图2:Mn-HSP体外抗肿瘤作用及机制。(A)Mn-HSP的细胞摄取共聚焦图像。(B)不同抑制剂(氯丙嗪、吲哚美辛和秋水仙碱)处理后Mn-HSP细胞摄取的共聚焦图像。(C)不同制剂处理后4T1细胞的代表性明场图像(黑色箭头表示细胞呈焦亡形态)。不同处理后4T1细胞中GSDME/GSDME-N(D)、caspase-3/cleaved caspase-3(E)和IFN-β(F)的WB分析。(G)静脉注射游离DiR、Mn-ASP@DiR、Mn-HSP@DiR后,不同时间荷4T1小鼠的实时活体图像。
该团队评估了Mn-HSP的体内抗肿瘤作用,治疗方案如图3 A所示。Mn-HSP显示出最佳的肿瘤抑制率(图3 B-E),表明联合细胞焦亡和STING通路有效增强了肿瘤抑制效果。H&E和Tunel染色结果进一步证明,Mn-HSP具有最佳的肿瘤杀伤效果(图3 G, H)。此外,在治疗期间各组小鼠体重无明显变化(图3 F),表明Mn-HSP具有良好的体内安全性。

图3:Mn-HSP对原发肿瘤的体内抗肿瘤作用。(A)抗原发肿瘤的治疗方案。(B)4T1荷瘤小鼠不同处理后24天解剖肿瘤照片。G1-Saline, G2-PTX-Mn, G3-HSP, G4-Mn-ASP, G5-Mn-HSP。(C)不同处理24d后4T1荷瘤小鼠肿瘤体积变化。(D)不同处理后第24天4T1荷瘤小鼠的肿瘤重量。(E)不同处理组小鼠肿瘤的生长曲线。(F)不同处理小鼠24天的体重变化。不同处理后肿瘤的H&E(G)和Tunel(H)染色图像。
肿瘤复发和转移是导致癌症死亡率居高不下的重要原因。该课题组进一步评价了Mn-HSP的抗肿瘤复发和转移效果。通过构建肿瘤复发(再挑战)模型(图4 A)表明,Mn-HSP治疗组可显著抑制小鼠复发肿瘤的生长(图4 C, D),且给药期间各组小鼠体重均未发生明显变化(图4 B)。另外,该团队在更具侵袭性的肺转移模型中评估了其抗肿瘤转移作用(图4 E)。结果表明,Mn-HSP治疗组可显著降低肺部转移灶的数目(图4 F),具有明显抑制肿瘤肺转移的作用。

图4:Mn-HSP对复发和转移肿瘤的抑制作用。(A)小鼠肿瘤再挑战实验方案。(B)不同治疗组在给药期间的体重变化。(C)各组给药后原发或再挑战肿瘤图像。G1-Saline, G2-PTX-Mn, G3-HSP, G4-Mn-HSP。(D)不同治疗组肿瘤重量统计。G1-Saline, G2-PTX-Mn, G3-HSP, G4-Mn-HSP。(E)肺转移评价示意图。(F)不同治疗组小鼠肺组织的H&E图(绿箭头和黑圈:转移灶)。
该团队构建了一种基于PTX和Mn2+的新型前药纳米平台Mn-HSP,通过PTX诱导肿瘤细胞焦亡和Mn2+激活STING通路将适应性免疫和先天性免疫相结合,触发循环免疫治疗显著抑制了肿瘤的复发和转移,为肿瘤的免疫治疗提供了新思路。
原文链接:https://www.sciencedirect.com/science/article/pii/S0142961224000061
【关闭】





