甲型流感病毒 (IAV) 引起的流感大爆发会给人类健康和社会经济造成巨大危害,而IAV引发的季节性流感每年也会导致约300-500万重症病例和29-65万人死亡。然而,目前的临床药物奥司他韦和金刚烷胺等存在耐药性及神经毒性等问题,故研发安全高效的新型抗IAV药物十分迫切。医药学院的王伟教授一直从事抗流感药物发现及作用机制研究,先后发现多个抗IAV先导化合物,包括靶向NA蛋白的喹哚啉衍生物7a和岩藻糖KW (J. Med. Chem., 2017; Sci. Rep., 2017),靶向RTK通路的聚酮化合物PPQ-B (Antivir. Res., 2017),以及靶向HA蛋白的吲哚生物碱PND和壳寡糖硫酸酯SCOS(J. Med. Chem., 2020;Carbohyd. Polym., 2022),为抗流感药物研发提供了借鉴。流感病毒的核蛋白 (NP) 是构成核衣壳的主要成分,参与病毒vRNP组装,RNA复制及病毒粒子装配 等过程。NP的多重功能和结构的保守性使得它成为抗IAV药物研究的热门靶点之一。
近日,王伟教授课题组和邵长伦教授课题组合作,在靶向NP蛋白的抗流感药物研究方面取得重要进展。研究团队利用抗IAV的分子、细胞和动物模型对海洋真菌来源的天然产物及其衍生物进行活性筛选,发现一种新结构的喹啉酮生物碱衍生物QLA对于H1N1和H3N2亚型的流感病毒都具有显著的抑制活性 (选择指数SI >100),优于阳性药利巴韦林和奥司他韦。此外,QLA口服给药能显著降低肺病毒滴度,提高小鼠生存率,减轻肺部病变,优于同剂量的奥司他韦。这表明QLA具有很好的抗IAV药物的研发潜力。
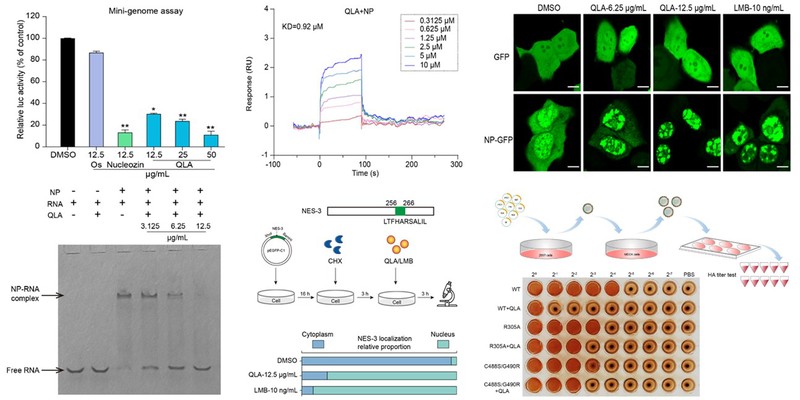
图1. QLA对NP蛋白不同功能的抑制作用研究
王伟教授课题组继续针对QLA抗IAV机制进行了系统研究。首先,微基因组和FISH实验表明QLA不仅抑制病毒vRNA复制和mRNA转录,还能抑制NP蛋白的细胞质定位和蛋白表达,表明QLA主要靶向病毒NP蛋白 (图1)。进一步研究发现QLA抑制病毒vRNA和vRNP出核而非mRNA出核,且抑制NP的NES3通过CRM1途径的出核;而SPR和Co-IP实验发现QLA能特异结合NP且干扰NP与CRM1的结合,表明QLA靶向抑制vRNP核质转运 (图1)。另外,QLA还能通过抑制NP与RNA结合而非NP寡聚化来干扰vRNP组装。最后,分子对接结合耐药株筛选和反向遗传学研究发现QLA主要作用于NP的Arg/Lys305、Cys488和Gly490,且这些氨基酸周围的结合口袋可作为NP靶向的抗IAV药物的潜在靶点。总之,QLA主要通过靶向NP来抑制RNP的组装和出核转运,从而抑制IAV的体内外感染 (图2)。本研究成果不仅为海洋真菌来源的抗IAV药物研发提供物质基础和理论参考,还可为靶向NP的新型抗IAV药物的理性设计提供借鉴,具有重要的理论意义和应用前景。
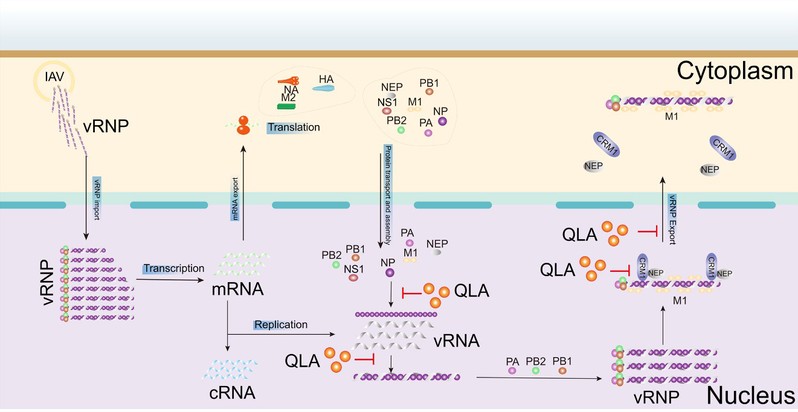
图2. QLA抗IAV作用的分子机制示意图
该研究成果于2023年2月在线发表于国际病毒学专业期刊Journal of Medical Virology(JCR一区,IF = 20.693)。医药学院的王伟教授和邵长伦教授为该成果的共同通讯作者,研究生张洋、徐伟峰和俞蕴嘉为并列第一作者。该研究得到了国家自然科学基金、国家基金委-山东省联合基金以及山东省面上基金等项目的资助。
Inhibition of influenza A virus replication by a marine derived quinolone alkaloid targeting virus nucleoprotein. Journal of Medical Virology, 2023, 95(2):e28499. doi: 10.1002/jmv.28499.
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/jmv.28499
【关闭】





