甲型流感病毒(Influenza A Virus,IAV)的爆发流行不仅给人类生命健康带来巨大威胁,还会带来巨大的经济损失。据WHO报道由H1N1 和H3N2 等亚型的IAV 引发的季节性流感每年在世界各地蔓延,导致大约300-500万例严重疾病和大约29-65万人死亡。但是目前上市的抗IAV药物种类少、副作用多、易产生耐药性。因此,研发低毒高效的新型抗IAV药物十分迫切。IAV的表面蛋白血凝素(HA)是目前备受关注的抗流感药物新靶标之一,其能够通过结合唾液酸及介导病毒膜融合来促进IAV的入侵和核蛋白体的释放。因而靶向HA的化合物有望研发成为新型的IAV侵入抑制剂,可广泛用于IAV的治疗和预防。
我院李德海教授课题组和王伟教授课题组十余年来通力合作,在新型抗甲型流感病毒药物研究方面取得重要进展。课题组前期发现了深海真菌来源的新骨架化合物penilactones A 和 B,并在此基础上预测了clavatol单元及与γ-丁内酯单元的结合很可能涉及非酶催化,且clavatol很可能存在一个化学活泼态,即ortho-Quinone methide(o-QM)等价物。而化学活泼态中间体模块在自然界中往往具有“武器库”和“解毒剂”的功能,所介导的非酶催化是形成天然产物结构和活性多样性的重要组成。受此启发,利用o-QM活泼态等价物,通过体外添加药效团结合化学衍生法共获得15个系列具有clavatol单元的类天然产物(pesudo natural product)。
随后,利用抗IAV的分子和细胞模型对这些类天然产物进行抗IAV活性筛选,发现系列产物具有不同程度的抗IAV作用,其中具有全新骨架结构的penindolone (PND)呈现出显著的体外抗IAV作用(SI > 55.0),优于阳性药Ribavirin和HA抑制剂Arbidol。PND的抗IAV作用具有广谱性,对H3N2和H1N1亚型的6种流感病毒株都具有显著的抑制作用,且不易产生耐药性。另外,PND口服或滴鼻给药都能够显著提高IAV感染小鼠的生存率,降低肺病毒滴度,减轻肺部炎性损伤,优于同剂量的临床药物奥司他韦。与奥司他韦作用于NA靶点不同,PND不抑制NA活性,但抑制HA介导的红细胞凝集和膜融合过程,表明其可能靶向于病毒的HA蛋白。
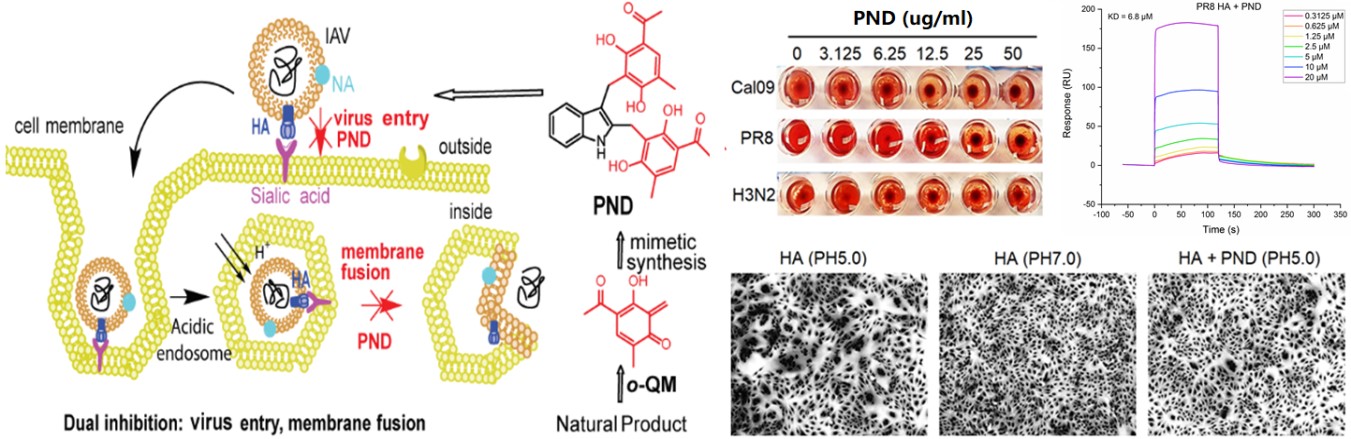
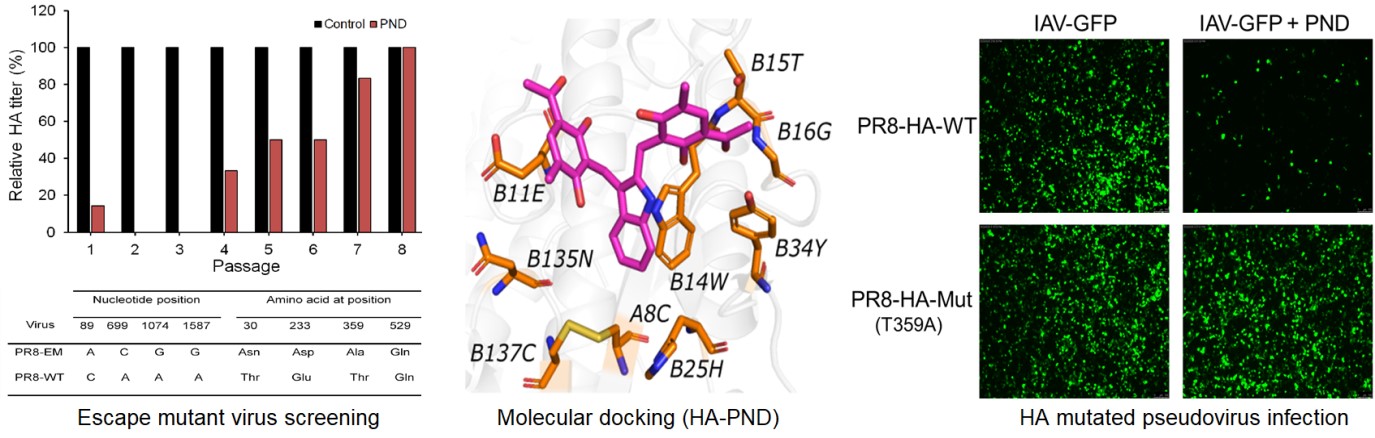
基于此,进一步利用SPR实验发现PND确实能够特异性结合H1N1和H3N2病毒的HA蛋白,且显著抑制H5N1禽流感假病毒的感染;而胰酶裂解实验和HA变构实验表明PND抑制HA2介导的变构但不抑制HA0的裂解。为探究PND作用位点,进一步利用计算机虚拟对接、耐药株筛选等技术研究提示PND可能主要通过结合HA2区段的15位Thr及附近氨基酸来稳定HA的融合前构象,从而阻止HA2变构为伸展状态。为了验证此假设,构建了HA点突变的IAV假病毒(IAV-GFP)结合荧光定量分析发现PND作用T359A点突变的假病毒几乎不能抑制其感染,表明T359位(HA2节段的15位Thr)是PND作用HA的关键结合位点,T30位(HA1的30位Thr)为次要结合位点。因此,PND以独特的作用模式同时结合HA1和HA2区段的Thr来干扰IAV的吸附和膜融合过程,从而抑制IAV的体内外侵染。总之,本研究不仅为新型抗IAV海洋药物的研发提供物质基础和理论参考,还将为靶向血凝素蛋白的抗IAV治疗提供借鉴。此外,PND能同时抑制IAV的吸附和膜融合,有别于传统的膜融合抑制剂阿比朵儿;且口服和滴鼻皆可发挥抗病毒作用,将可作为达菲等抗IAV药物的一个补充,具有广阔的应用前景。
该研究成果于2020年6月10日在线发表于药学顶尖期刊Journal of Medicinal Chemistry(药学一区,TOP期刊)。医药学院李德海教授和王伟教授为该成果的共同通讯作者,研究生吴广畏,于桂洪,俞蕴嘉和青年教师杨爽副教授为并列第一作者。该研究得到了国家自然科学基金、国家基金委-山东省联合基金以及山东省面上基金等项目的资助。
Chemoreactive-inspired discovery of influenza A virus dual inhibitor to block hemagglutinin-mediated adsorption and membrane fusion. J. Med. Chem., 2020 Jun 10, DOI: 10.1021/acs.jmedchem.0c00312.
文章链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c00312
【关闭】





