| 于日磊 | 博士 | 教授 | 博士生导师 | |
科 室: | 药物设计与合成 | ||||
办公电话: | 0532-82031905 | 电子邮箱: | ryu@ouc.edu.cn | ||
联系地址: | 山东省青岛市鱼山路5号中国海洋大学医药学院266003 | ||||
研究方向: | 1.海洋多肽药物设计、合成与构-效关系研究 2.约束肽药物设计、合成与活性研究 3.靶向膜蛋白受体的海洋活性化合物发现与作用机制研究 4. 计算机辅助药物设计与分子动力学模拟 | ||||
个人简介 |
|
|
|
| |
主要从事海洋来源活性多肽的设计、合成与构-效关系研究,主持并参与国家自然科学基金项目(优青、面上及青年项目)、国家实验室主任基金、国家重点研发计划深海装备(深海毒素)项目等,以第一与通讯作者在Mol. Cell、PharmacolTher.、J. Med. Chem.、Br. J. Pharmacol. 、Eur. J. Med Chem.等国际权威期刊发表SCI 论文30余篇,申请国家发明专利8项,PCT 1项,授权专利1项,获得软件著作权1项,应邀在国内、国际学术会议做报告10余次,获得2020年山东省高等学校科学技术奖二等奖(位2)。 | |||||
教育背景 |
|
|
|
| |
2009年6月至2013年1月 | 昆士兰大学 分子生物研究院 | 药物化学 | 博士 | ||
工作经历 |
|
|
|
| |
2020年9月至今 | 中国海洋大学 医药学院 | 教授 |
| ||
2014年10月至2020年8月 | 中国海洋大学 医药学院 | 副教授 |
| ||
2013年1月至2014年9月 | 牛津大学 生物化学系 | 博士后 |
| ||
学术兼职 |
|
|
|
| |
担任中国药学会高级会员、中国药学会智能药物委员会委员、中国药学会海洋药物青年委员会委员。担任J Med Chem、Br J Pharmacol、Eur J Med Chem、Neuropharmacol,J Chem Inf M及ACS Chem Neurosci等杂志审稿人。 | |||||
荣誉奖励 |
|
|
|
| |
1.2021年国家优青 2.2020年山东省高等学校科学技术奖二等奖(位2) 3.2019年11月海洋药物化学会议年会-青年论坛优秀报告奖(二等) 4.2018年12月 国家实验室青年论坛优秀报告奖(三等)
| |||||
研究兴趣 |
|
|
|
| |
课题组采用高度交叉的方法,包括计算模拟-基因组学-人工智能-化学合成-电生理学-结构解析的策略发现海洋先导化合物或多肽、理解先导分子作用的药物化学基础与作用机制。在此基础上,采用现代药物设计方法,开展海洋先导分子结构优化、构-效关系研究与成药性评价。具体研究方向包括: 1. 针对海洋多肽(如芋螺毒素)联合采用计算生物学、人工智能、合成化学与电生理学开展先导分子发现、作用机制研究,在原子水平揭示海洋多肽结构与功能的关系;基于对多肽构-效关系的理解,开展结构优化,进一步提高其活性与选择性。
2. 针对高度动态蛋白,尤其离子通道膜蛋白采用分子动力学模拟联合定点突变实验,研究蛋白的动态结构与功能关系,在原子水平理解蛋白或配体的构象扰动或变构调控机制。
3. 针对天然来源或采用从头设计方法获得的结构稳定、分子量较小的约束肽,采用嫁接、二硫键替换、环化、非天然修饰等化学生物学策略优化多肽稳定性与生物利用度,获得具有成药前景的功能多肽。
| |||||
代表性成果 | |||||
代表性论文(*corresponding author): | |||||
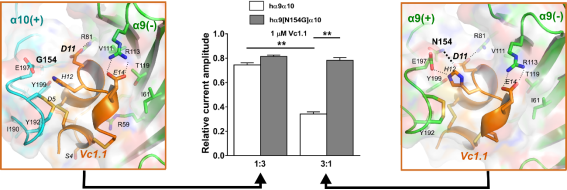
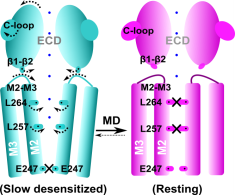
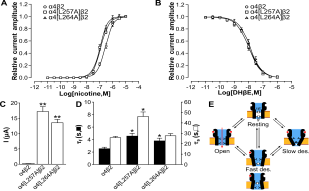
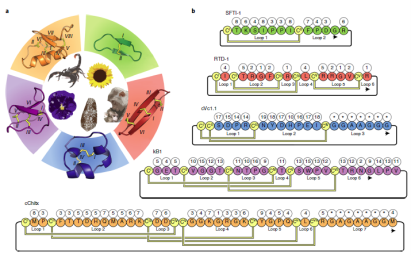
1. Tong Y, Guo D, Lin SH, Liang J, Yang D, Ma C, Shao F, Li M, Yu Q, Jiang Y, Li L, Fang J,Rilei Yu*, Lu Z*.SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells.Mol Cell. 2021 Jun 3;81(11):2303-2316.e8 (IF: 17.97) 2. Li X, Tae HS, Chu Y, Jiang T, Adams DJ*,Rilei Yu*.Medicinal chemistry, pharmacology, and therapeutic potential of α-conotoxins antagonizing the α9α10 nicotinic acetylcholine receptor.PharmacolTher. 2021 Jun;222:107792.(IF:12.3) 3. Jiazhen Liang, Han-Shen Tae, Xiaoxiao Xu, Tao Jiang, David J. Adams and Rilei Yu*. Dimerization of α-conotoxins as a strategy to enhance the inhibition of the human α7 and α9α10 nicotinic acetylcholine receptors. J. Med. Chem. 2020 Feb 26. doi: 10.1021/acs.jmedchem.9b01536. (IF:6.2) 4. Rilei Yu*, Wang J, So LY, Harvey PJ, Shi J, Liang J, Dou Q, Li X, Yan X, Huang YH, Xu Q, Kaas Q, Chow HY, Wong KY, Craik DJ, Zhang X, Jiang T, Wang Y*. Enhanced Activity against Multi-drug Resistant Bacteria through Coapplication of an Analogue of Tachyplesin I and an Inhibitor of the QseC/B Signaling Pathway. J. Med. Chem. 2020 Jan 31. doi: 10.1021/acs.jmedchem.9b01563. (IF:6.2) 5. Rilei Yu*, Han-Shen Tae, Qingliang Xu, David J. Craik, David J. Adams, Tao Jiang and Quentin Kaas*. An antagonist-bound structure of the human α4β2 nicotinic acetylcholine receptor. Br. J. Pharmacol.,2019,doi: 10.1111/bph.14698(IF:7.2) 6. Rilei Yu*#, Han-Shen Tae#, Nargis Tabassum, Juan Shi, Tao Jiang, and David J. Adams*. Molecular determinants conferring the stoichiometric-dependent activity of α-conotoxins at the human α9α10 nicotinic acetylcholine receptor subtype. J. Med. Chem., 2018. DOI: 10.1021/acs.jmedchem.8b00115(IF:6.2) 7.Rilei Yu.; Kompella, S. N.; Adams, D. J.; Craik, D. J.*; Kaas, Q.* Determination of the α-Conotoxin Vc1.1 Binding Site on the α9α10 Nicotinic Acetylcholine Receptor. J. Med. Chem. 2013, 56 (9), 3557–3567.(IF:5.3) 8. Zhang Y, Yin R, Wu G, Yu M, Liu J, Wang X, Liu X, Guan H, Rilei Yu,* Jiang T*.Self-assembling nanoparticles of dually hydrophobic prodrugs constructed from camptothecin analogue for cancer therapy.Eur J Med Chem. 2020 Aug 15;200:112365. doi: 10.1016/j.ejmech.2020.112365. Epub 2020 Apr 30.(IF:5.5) 9. Rilei Yu, Craik DJ, Kaas Q.*Blockade of neuronal α7-nAChR by α-conotoxin ImI explained by computational scanning and energy calculations.PLoSComput Biol.2011 Mar;7(3):e1002011. doi: 10.1371/journal.pcbi.1002011. Epub 2011 Mar 3 (IF:5.3)
| |||||
专利 |
|
|
|
| |
1. 于日磊、史娟、江涛,一种氨基酸全部选用D型氨基酸的抗菌肽合成方法,国家发明专利,授权号ZL201810221262.9 2. 于日磊、刘昊等,芋螺毒素复合物结构数据库软件,软件著作权,授权号2020SR0229866; 3. 于日磊、梁家珍,徐锡明,一种α-芋螺毒素Mr1.1及其突变体Mr1.1[I15L],国家发明专利,专利号ZL201811402578.4;
| |||||
项目课题 | |||||
1. 国家自然基金优秀青年基金,8212200560,海洋多肽药物化学,2022/01-2024/12,在研,主持 2. 国家自然基金面上项目,3217110331,具有新型作用模式的α芋螺毒素Mr1.1的结构优化与作用机制研究,2022/01-2025/12,在研,主持 3. 国家实验室主任基金,QNLM201709,海洋化合物三维数据库构建与抗肿瘤蛋白靶标虚拟筛选研究,2018/01-2019/12,结题,主持 4. 国家自然科学基金青年科学基金项目,81502977,具有新颖二硫键骨架的环α型芋螺毒素类似物的设计与构效学研究,2016/01-2018/12,结题,主持 5. 国家重点研发计划-深海毒素项目(重要深海生物毒素及生物伤防护关键技术研究),SQ2019YFC030364, 2020/01-2021/12,在研,子课题负责人 6. 国家自然科学基金重点项目,41830535,基于化学生态效应的珊瑚礁药用生物新资源发现, 2019/01- 2023/12 在研,参与(位2) 7. 中央高校基本业务经费(培育项目),201941012,超算模拟驱动的海洋活性分子发现与作用机制研究,2019/01-2021/12,在研,主持 | |||||
【关闭】