
肿瘤免疫治疗的难点在于肿瘤微环境中的乏氧和免疫抑制状态,导致免疫细胞难以有效识别和攻击肿瘤细胞。肿瘤的免疫原性细胞死亡(ICD)是提高肿瘤免疫原性的关键,铜死亡作为一种新型的程序性细胞死亡方式与ICD密切相关。但是,乏氧微环境会促进肿瘤细胞代谢重编程(Warburg效应),降低对铜死亡的敏感性进而抑制ICD发生。因此,如何减轻乏氧和增强肿瘤细胞对铜死亡的敏感性,并逆转TME是肿瘤免疫治疗亟待解决的问题。
为了克服这些挑战,中国海洋大学医药学院、山东省糖科学与糖药物重点实验室赵峡教授团队构建了一种新型的锌掺杂硫化铜纳米花氧泵微针(OPMNs-ZCS@siPD-L1),通过“铜锌协力”激活STING通路并诱导免疫原性死亡(ICD)效应(“踩油门”策略),并通过siPD-L1逆转肿瘤免疫抑制微环境(TME)和OPMNs缓解乏氧(“松刹车”策略),显著增强了肿瘤的免疫治疗效果(图1)。
该研究通过构建黑色素瘤小鼠模型(图2A),证实了OPMNs-ZCS@siPD-L1在体内的抗肿瘤免疫治疗效果。结果表明,OPMNs-ZCS@siPD-L1显著抑制了原位肿瘤和再挑战肿瘤的生长(图2C-F),并明显抑制了肿瘤的肺转移(图2G)。
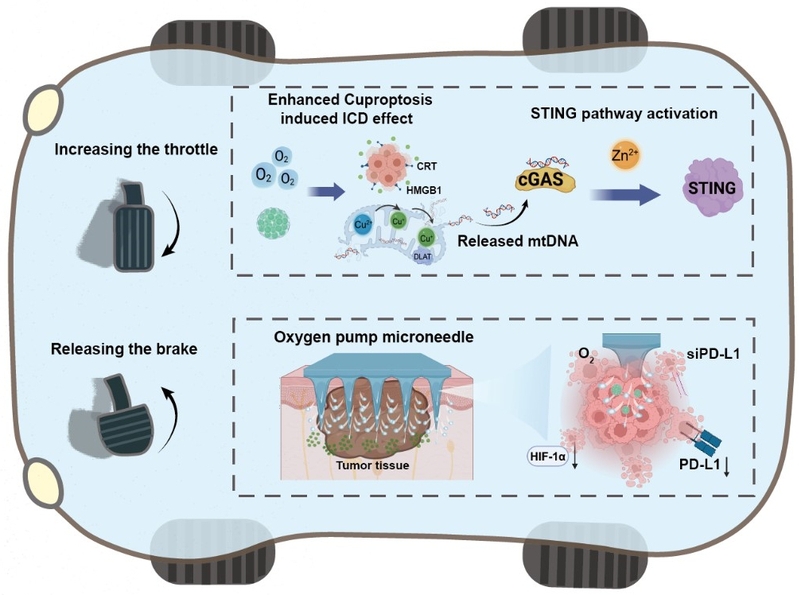
图1:负载ZCS NFs和siPD-L1的氧泵微针用于癌症免疫治疗的示意图。
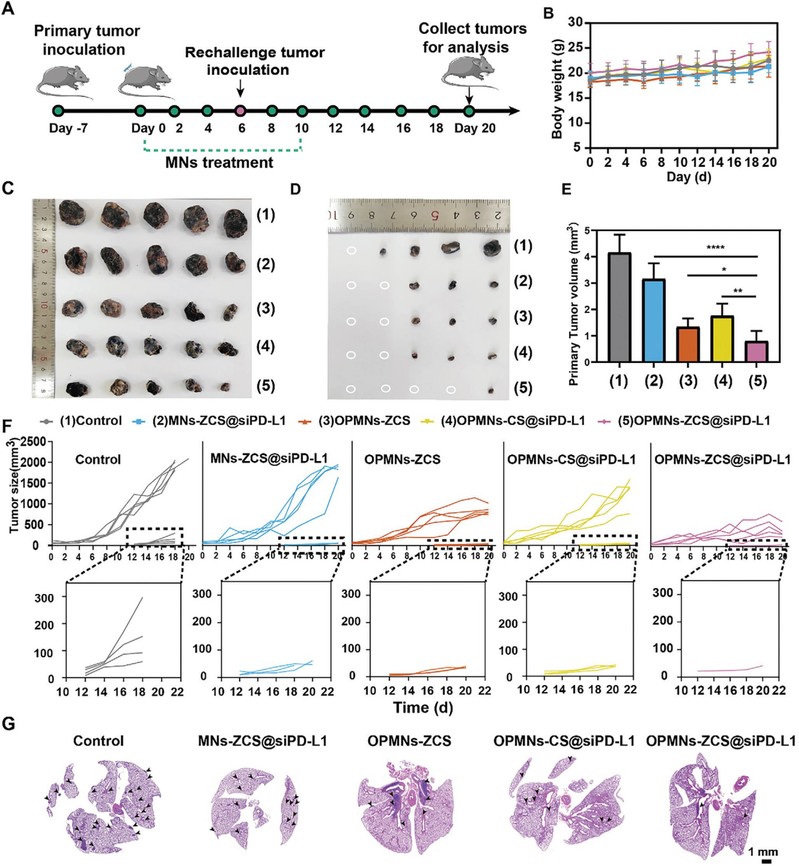
图2:OPMNs-ZCS@siPD-L1在体内的抗肿瘤免疫治疗效果。A) 肿瘤再挑战模型的构建和药物给药示意图。B) 20 d治疗期间各组小鼠的体重变化。C) 治疗20 d后各组原发肿瘤的数码照片,1) 对照组,2) MNs-ZCS@siPD-L1组,3) OPMNs-ZCS组,4) OPMNs-CS@siPD-L1组,5) OPMNs-ZCS@siPD-L1组。D) 各组再挑战肿瘤的数码照片。E) 不同制剂处理后肿瘤的重量。F) 20 d治疗期间各组原发肿瘤和再挑战肿瘤的体积变化曲线。G) 不同制剂处理后小鼠肺的苏木精和伊红染色图像(黑色箭头:转移灶)。
该研究构建了一种新型的氧泵微针系统(OPMNs-ZCS@siPD-L1),通过“踩油门”和“松刹车”双重策略,显著增强了肿瘤免疫治疗效果,为经皮肿瘤免疫治疗提供了新思路。与其他微针相比,OPMNs-ZCS@siPD-L1的优势如下:
增强药物渗透和改善乏氧:先前报道的大多数肿瘤治疗微针,忽略了药物渗透性不足的问题。尽管我们之前的研究报道了基于CO₂的气泡泵微针促进了药物渗透,但肿瘤组织的乏氧微环境并未改善。该研究构建的氧泵微针不仅促进了药物向肿瘤组织的渗透,还通过产生氧气改善了乏氧微环境。
“踩油门”和“松刹车”策略:先前报道的肿瘤治疗策略主要集中在缓解免疫抑制或增强肿瘤免疫反应某一方面。该研究通过“踩油门”策略来激活STING通路并诱导ICD效应,并通过“松刹车”策略来缓解乏氧和解除PD-L1免疫抑制,将增强肿瘤免疫反应与缓解免疫抑制两种策略的联合应用,更有助于提升肿瘤免疫治疗的效果。
铜死亡与STING通路激活:该研究首次阐明了铜死亡与STING通路之间的联系。研究发现,铜死亡发生会伴随线粒体的损伤导致mtDNA释放,激活STING通路介导的先天免疫,进而增强肿瘤免疫治疗效果。
相关研究成果近期以“Dual Metal Nanoflower Oxygen Pump Microneedles Based on Cuproptosis and STING Pathway Activation for Cancer Immunotherapy”为题,近日发表于《Small》(IF=13.0,TOP期刊)。中国海洋大学医药学院2022级博士研究生陶娇娇为该论文第一作者,赵峡教授为通讯作者。
原文链接:https://doi.org/10.1002/smll.202409187
