阿尔兹海默症(Alzheimer’s disease, AD)是一种常见的神经退行性疾病,其病理特征之一是微管相关蛋白tau蛋白的过度磷酸化与异常聚集。有研究显示tau蛋白的磷酸化可能通过诱导蛋白构象变化来调控其功能和致病性。然而,作为一种内在无序蛋白(Intrinsically disordered protein, IDP),tau蛋白的构象具有高度的动态性和异质性,这使得利用传统结构解析技术难以捕捉其致病性构象,成为结构生物学领域的重大挑战。单分子荧光共振能量转移(single-molecule Förster resonance energy transfer, smFRET)为研究IDPs的动态构象提供了可能。胶体半导体量子点(Quantum dots, QDs)因其发射波长可调、高量子产率以及优异的光稳定性,被视为理想的荧光团。但由于其尺寸相比小分子染料较大,尚未获得在smFRET中的应用。
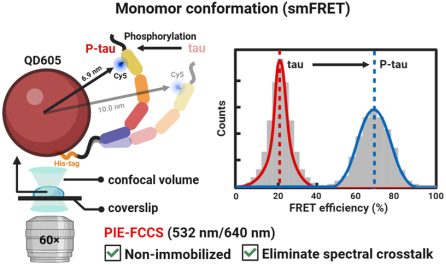
图1. 单分子荧光共振能量转移技术探究tau和P-tau蛋白构象的示意图
近日,中国海洋大学医药学院邱雪课题组与中国科学院深圳先进技术研究院郭佳佳副研究员合作在化学权威期刊《Journal of Colloid and Interface Science》发表了一篇题为“Quantum-dot-based single-molecule Förster resonance energy transfer for investigating the conformations of tau and phosphorylated tau”的研究论文,团队利用脉冲交错激发荧光互相关光谱(Pulsed interleaved excitation-fluorescence cross-correlation spectroscopy, PIE-FCCS),首次在生理环境中捕获到QD作为FRET供体、有机染料作为FRET受体的双标记蛋白的smFRET信号,并成功探测到由病理性磷酸化驱动的tau蛋白的整体构象变化。脉冲交错激发(PIE)使用两个在时间上交替的皮秒激光脉冲,分别激发不同的荧光探针,而荧光互相关光谱(FCCS)是一种通过分析两个不同荧光通道信号涨落的互相关性,来定量研究分子间相互作用或分子内构象变化的单分子检测技术。PIE技术能有效消除QD与受体染料(如Cy5)之间的光谱串扰,而FCCS可直接在溶液体系对smFRET信号进行测量,有效规避了QD的尺寸在smFRET测试中带来的不利影响。
该研究利用重组tau蛋白N端的His-tag,通过金属配位作用将其定向、计量可控地固定在ZnS包覆的QD605表面(QD和tau的化学计量比1:1),有效避免了偶联比不确定带来的FRET模式(单供体/单受体;单供体/多受体;多供体/单受体等)的改变。野生型tau蛋白291和322位的半胱氨酸被突变为丙氨酸,C端432位的缬氨酸被突变为半胱氨酸,以实现位点特异性的Cy5(FRET受体)标记。QD605-Cy5具有比较大的Förster距离(R0=8.0 nm,FRET效率为50%时供受体之间的距离),使其成为测量IDP整体构象变化的理想选择。
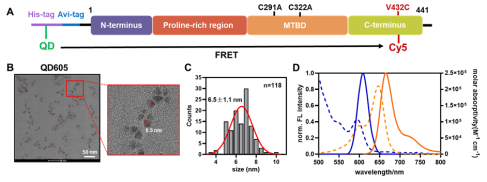
图2. 用于tau蛋白构象分析的QD605-Cy5 FRET体系构建
smFRET结果显示,正常tau蛋白组的FRET效率为20.0 ± 8.3 %,供受体的平均距离为10.0 ± 1.0 nm;而发生病理性磷酸化后,P-tau蛋白的FRET效率显著提高到70.1 ± 15.1 %,供受体平均距离显著缩短至6.9 ± 1.3 nm。这一发现证实了磷酸化可显著诱导tau单体的整体构象收缩,其为进一步在分子水平上阐明tau蛋白的聚集诱发机制提供了关键结构信息。
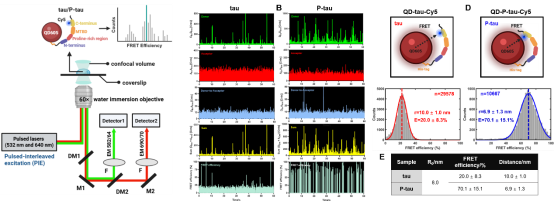
图3. QD-Cy5 smFRET体系揭示tau和P-tau蛋白的单分子结构信息
该论文拓展了QDs在smFRET分子构象研究中的应用,为在生理环境中研究内在无序蛋白(如tau蛋白)的分子构象提供了一种直接、普适的方法。这一成果对于推动阿尔兹海默症、tau蛋白病等神经退行性疾病的结构生物学研究具有重要意义。
中国海洋大学医药学院为本文的第一通讯单位,邱雪教授和中国科学院深圳先进技术研究院郭佳佳副研究员为文章的共同通讯作者,中国海洋大学医药学院博士研究生朱玫霖为第一作者。本工作得到了山东省泰山学者青年专家项目、山东省优青、青岛海洋科技中心科技创新项目、国家自然基金青年科学基金等项目的资助。
原文链接:https://doi.org/10.1016/j.jcis.2025.139663
【关闭】





