| 肖菲 | 博士 | 副教授 | 硕士生导师 | |
科 室: | 海洋药物合成生物学 | ||||
办公电话: | 0532-82031813 | 电子邮箱: | xiaofei3450@ouc.edu.cn | ||
联系地址: | 山东省青岛市鱼山路5号中国海洋大学医药学院产业楼201 | ||||
研究方向: | 1. 海洋药源分子的靶向挖掘及生物合成机制解析 2. 海洋药源分子生物合成关键酶催化机制解析及酶工程改造
| ||||
个人简介 |
|
|
|
| |
主要从事海洋药源天然产物生物合成分子机制研究,致力于采用体内遗传学、体外酶学和蛋白晶体学阐明海洋微生物次级代谢产物生物合成途径中关键酶分子催化机制,进一步通过酶工程改造、功能元件的优化组合实现活性分子的结构优化。近年来,在J. Am. Chem. Soc.、ACS Catal.、Appl. Environ. Microb.、J. Nat. Prod.等国际权威期刊发表SCI论文10余篇,授权发明专利3项,包括美国PCT专利1项。主持国家自然科学基金、山东省自然科学基金等多项课题。 | |||||
教育背景 |
|
|
|
| |
2013.09~2019.01 | 中国海洋大学 医药学院 | 微生物与生化药学 | 博士 | ||
2009.09~2013.06 | 中国海洋大学 医药学院 | 药学 | 学士 | ||
工作经历 |
|
|
|
| |
2015.01~今 | 中国海洋大学 医药学院 | 副教授 |
| ||
2021.03~2024.12 | 中国海洋大学 医药学院 | 讲师 |
| ||
2019.09~2021.02 | 中国海洋大学 海洋生命学院 | 博士后 |
| ||
学术兼职 |
|
|
|
| |
中国微生物学会永久会员,中国研究型医院学会微生物感染与转化专业委员会青年委员 《The Innovation》青年编委 | |||||
荣誉奖励 | |||||
2021年 第八届大学生科技创新大赛校级特等奖(指导教师) | |||||
2022年 第二届国际定向进化大赛全球银奖(指导教师) | |||||
2023年 第三届国际定向进化大赛全球铜奖(指导教师) | |||||
2024年 《微生物学》课程获评第三批山东省一流本科课程(2/4)
| |||||
研究进展 |
|
|
|
| |
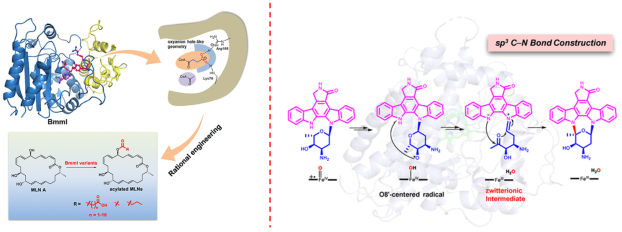
海洋天然产物是创新药物研发的重要源泉,解析其生物合成途径并阐明关键元件的催化机制,对通过合成生物学实现化合物的理性设计和结构优化具有重要意义。近年来围绕海洋微生物活性天然产物的挖掘和生物合成机制研究,我们取得了以下几方面的研究成果: 1、海洋药源分子生物合成途径解析和重构 Streptocarbazoles类化合物具有独特的C1′‒N13和C3′‒N12糖苷键,通过生物合成途径的理性改造和异源重构,获得了抗肿瘤活性良好的衍生物,进一步采用基因阻断和异源表达探究了其生物合成机制;通过异源表达激活了二酮哌嗪类化合物lansais,进一步通过体内基因阻断和体外生化实验,阐明了该类化合物的生物合成途径。以上结果为开展药源分子的理性设计和结构改造提供了重要基础。 2、海洋药源分子生物合成途径关键功能元件的酶学机制解析 酰基基团是许多活性天然产物的药效基团,通过体内遗传学、体外酶学和蛋白晶体学解析了Macrolactins酰基化后修饰的分子机制;Staurosporine是蛋白激酶C的有效抑制剂,首次通过体内遗传学和体外酶学阐明了由细胞色素P450酶催化的N12‒C5′糖苷键组装步骤,并采用蛋白晶体学和QM/MM计算揭示了其新颖的分子催化机制。以上结果为药源分子的高效合成和结构改造提供了有力功能元件。
| |||||
代表性成果 | |||||
代表性论文(*corresponding author): | |||||
1. He Duan, Meifang Zhang, Zhenshan Chen, Xin Wang, Fei Xiao*, Wenli Li*. Unveiling a pyrroloindoline diketopiperazine biosynthetic pathway featuring a phytoene-synthase-like family prenyltransferase with distinct regioselectivity. Bioorg. Chem., 2025, 160:108448. 2. He Duan, Meifang Zhang, Xin Wang, Fei Xiao*, Wenli Li*. Generation of glucosylantimycins by heterologous expression of a promiscuous glycosyltransferase in a deepsea-derived Streptomyces. Nat. Prod. Res., 2025, 13:1-9. 3. Fei Xiao#, Tai-Ping Zhou#, Sheng Dong, Tong Li, Cai-Hong Yun, Yingang Feng, Qiu Cui, Kui Hong, Binju Wang*, Wenli Li*. Molecular basis for the P450-catalyzed sp3 C−N glycosidic bond formation in staurosporine biosynthesis. ACS Catal., 2024, 14(19):14274–14284. 4. Fei Xiao, Mingyuan Xu, Yongmeng Cheng, Tong Li, Kui Hong, Wenli Li*. Generation of streptocarbazoles with cytotoxicities by pathway engineering and insights into their biosynthesis. Appl. Environ. Microbiol., 2024, 90(3):e0218723. 5. Qiannan Sun, Dongqi Yu, Xueqing Zhang, Fei Xiao*, Wenli Li*. The discovery of cyclic lipopeptide olenamidonins in a deepsea-derived Streptomyces strain by knocking out a DtxR family regulator. Mar. Drugs, 2024, 22(6):262. 6. Fei Xiao, Sheng Dong, Yang Liu, Yingang Feng, Huayue Li, Cai-Hong Yun, Qiu Cui, Wenli Li*. Structural basis of specificity for carboxyl-terminated acyl donors in a bacterial acyltransferase. J. Am. Chem. Soc., 2020, 142(37):16031-16038. 7. Ting Wu, Fei Xiao*, Wenli Li*. Macrolactins: biological activity and biosynthesis. Mar. Life Sci. Technol., 2020, 3(1):62-68. 8. Fei Xiao, Huayue Li, Mingyuan Xu, Tong Li, Ju Wang, Chaomin Sun, Kui Hong, Wenli Li*. Staurosporine derivatives generated by pathway engineering in a heterologous host and their cytotoxic selectivity. J. Nat. Prod., 2018, 81(8):1745-1751. | |||||
专利 |
|
|
|
| |
1. 李文利,肖菲,李花月,徐明远,李通.具有细胞毒活性的吲哚咔唑类生物碱及制备方法、用途. 2020.04.28中国,ZL201810160712.8. 2. 李文利,肖菲,刘扬.一种具有酰基转移功能的酶及其应用. 2022.09.13中国, ZL202010083819.4. 3. Wenli Li,Fei Xiao,Yang Liu, Huayue Li.Enzyme with acyl transfer function and application thereof, 2024.10.01, US12104180B2. | |||||
项目课题 | |||||
1. 国家自然科学基金青年项目,32100051,新颖吡咯杂萜类化合物pyrrolostamines生物合成机制研究,2022/01-2024/12,主持 2. 山东省自然科学基金青年项目,ZR2021QC013,细胞毒活性及选择性良好的吲哚咔唑类化合物的理性设计与智造,2022/01-2024/12,主持 3. 国家自然科学基金联合基金重点项目,U22A20582,功能元件导向的深海微生物抗感染先导化合物的靶向发现和理性智造,2023/01-2026/12,参与(校内子课题负责人) 4. 山东省自然科学基金重大基础研究项目,ZR2021ZD28,深海微生物药用活性分子的高效发现与作用机制研究,2022/01-2024/12,参与 5. 青岛市应用研究项目,862005040012,细胞毒活性及选择性良好的吲哚咔唑类化合物的理性设计与智造,2019/09-2021/09,主持 | |||||
【关闭】