
2月14日,中国海洋大学医药学院、海洋药物教育部重点实验室、青岛海洋科技中心海洋药物与生物制品功能实验室李德海教授团队在国际顶级化学学术期刊Journal of the American Chemical Society(JACS)在线发表了题为“Biosynthesis of Dothideomins Reveals a Fungal P450 That Constructs the Tricyclo[5.2.2.0.4,8]undecane-Imbedded Core Skeleton”的研究论文。
具有复杂多样的结构和显著生物活性的天然产物是药物先导化合物的重要来源。二聚蒽醌也被称为双蒽醌(BQs),由两个相同或不同的蒽醌单体通过C-C或C-O键连接而成。其中,dothieomins A–D是一类具有独特的6/6/6/5/6/6/6七环或6/6/6/5/6/3/6/6八环体系的且具有良好抗菌活性的笼状BQ类化合物,同时还具有与其他BQ骨架完全不同的三环[5.2.2.0.4,8]十一烷嵌入式核心骨架。
李德海课题组通过基因组挖掘、生物合成基因簇的异源表达、底物饲喂以及体外生化实验阐明了笼状二聚蒽醌类化合物dothideomins C(9)和D(10)的生物合成过程。其新颖且复杂的三环[5.2.2.0.4,8]十一烷核心骨架由细胞色素P450单加氧酶(P450)DotG单独催化前体大黄素(1)的二聚化以及后续中间体的开环及脱碳反应形成(图1)。随后基于分子对接、氨基酸的定点突变实验确定了DotG蛋白中参与催化的关键氨基酸残基,并在此基础上针对化合物8合成过程中的关键步骤进行了DFT计算,进一步证明DotG催化大黄素(1)合成笼状中间体8的合理性。最后,分别通过体外蛋白实验以及构巢喂养实验确定醛酮还原酶(AKR)DotH和短链脱氢/还原酶(SDR)DotM的功能。具体而言,DotH既可以单独催化化合物8的立体选择性还原以合成dothideomin C(9),也能与DotG一起催化(+)-rugulosin A(12)的生物合成;而DotM可以催化dothideomin C(9)的立体选择性还原以合成dothideomin D(10)(图1)。与(+)-rugulosin A(12)的生物合成相比,该研究结果强调了P450和AKR在决定BQs组装模式中的重要作用,其中P450的影响尤为显著。
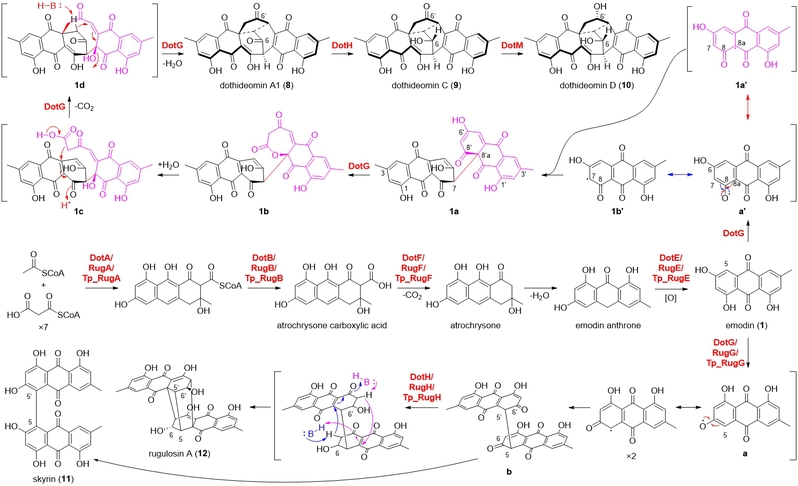
图1. Dothideomins C(9)和D(10)可能的生物合成路径
中国海洋大学为第一通讯单位,李德海教授为通讯作者,医药学院博士研究生张发雷、博士后马传腾以及蚌埠医科大学朱美林副教授为本论文的共同第一作者,陈颖涵、王文雪、张国建教授、朱天骄教授、车茜副教授为文章共同作者。本论文得到了青岛海洋科技中心科技创新项目、中央高校基础研究基金、国家R&D重点项目和山东省泰山学者特聘专家项目的资助。
原文链接:https://doi.org/10.1021/jacs.4c18595
【关闭】





