
光动力疗法(PDT)由于具有“照哪打哪”的时空选择性、微创性和副作用低等优势,近年来受到了人们的广泛关注。然而,PDT的临床疗效却受到深藏在肿瘤组织内的癌症干细胞(CSC)的限制。CSC可谓是集各派武功于一身,不仅可以不断自我更新增殖或变身成普通的癌细胞抵抗药物的攻击,而且在自身DNA损伤后还自带修复神功快速恢复正常功能,使得肿瘤的治疗就像离离原上草一样“野火烧不尽,春风吹又生”,并容易导致肿瘤的复发和转移。
近期,赵峡教授团队针对CSC强大的DNA损伤修复功能和难以杀灭的特点,设计了一种将可“废除CSC修复DNA神功”的奥拉帕尼(OLA)、可在红外光照下产生活性氧(ROS)的二氢卟吩e6(Ce6)和可定位CSC表面CD44受体的透明质酸(HA)“三剑客”于一身的纳米靶向胶束,明显逆转了CSCs的耐药性和提高了PDT的抗肿瘤疗效,并可有效抑制肿瘤的复发和转移。相关成果以“Reversing Resistance of Cancer Stem Cells and Enhancing Pdt Based on Hyaluronic Acid Nanomicelles for Preventing Cancer Recurrence and Metastasis”为题,2023年11月8日在线发表于《Advanced Healthcare Materials》(IF=10.0)。中国海洋大学医药学院2021级博士研究生王腾为该论文的第一作者,赵峡教授为通讯作者。
该研究将亲水性HA通过胱胺(Cys)与疏水性Ce6连接,获得两亲性胶束(HA‐Cys‐Ce6,HCC)用来包裹DNA损伤修复抑制剂OLA。HA可与CSCs表面过表达的CD44受体特异性结合,将负载OLA的胶束(HCCO)靶向递送至肿瘤内的CSCs。Ce6可以通过产生ROS来实现肿瘤的PDT治疗,并诱导肿瘤免疫原性细胞死亡(ICD)和激活抗肿瘤免疫。将Ce6介导的PDT和OLA介导的DNA损伤修复抑制相结合,可协调增强ICD效应并抑制髓源抑制细胞(MDSC)的浸润,从而有效逆转CSC的治疗耐药性,并提高PDT的抗肿瘤疗效(图1)。
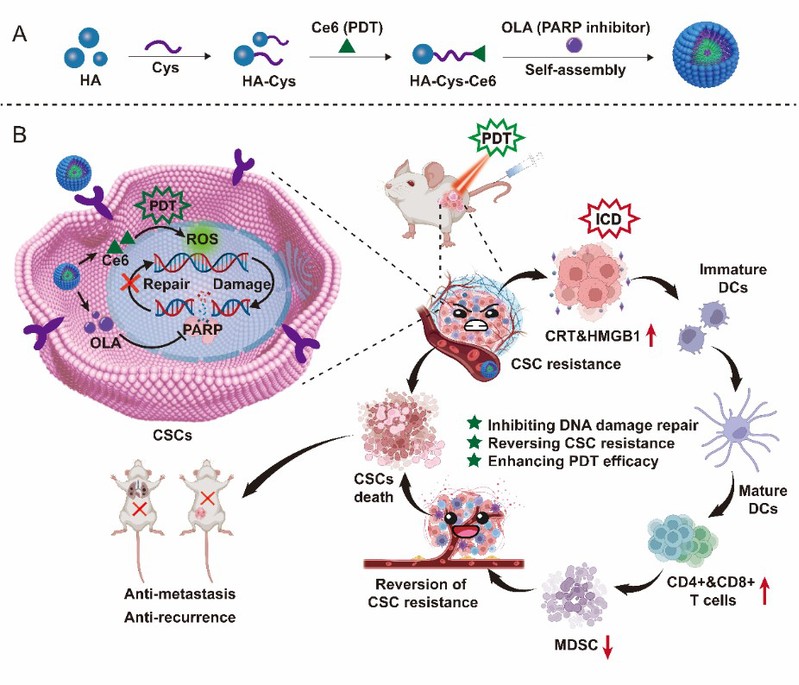
图1:HCCO逆转癌症干细胞耐药性和增强PDT的示意图。A)HCCO的制备。B)HCCO逆转CSC免疫抑制微环境并诱导不可逆的DNA损伤以抑制乳腺癌症复发和转移。
为了评估HCC胶束的肿瘤靶向能力,将香豆素-6(Cou)作为荧光示踪信号加载到HCC胶束中(HCC@Cou)。结果表明,HCC@Cou处理的4T1细胞显示出更高的细胞摄取(图2A-C),表明HCC具有明显的癌症细胞靶向能力。在4T1-CSC中HCC@Cou的荧光信号同样高于游离的Cou胶束(图2E),表明HCC胶束有效增强了CSCs的摄取。HCCO在体内肿瘤切片中表现出强烈的红色荧光(Ce6)(图2F),表明其具有良好的靶向性和渗透性。此外,HCCO显示出清晰的红色荧光并与CSC的标志物ALDH1高度共定位(合并的黄色荧光)(图2F),表明HCCO具有强大的CSC体内靶向潜力。
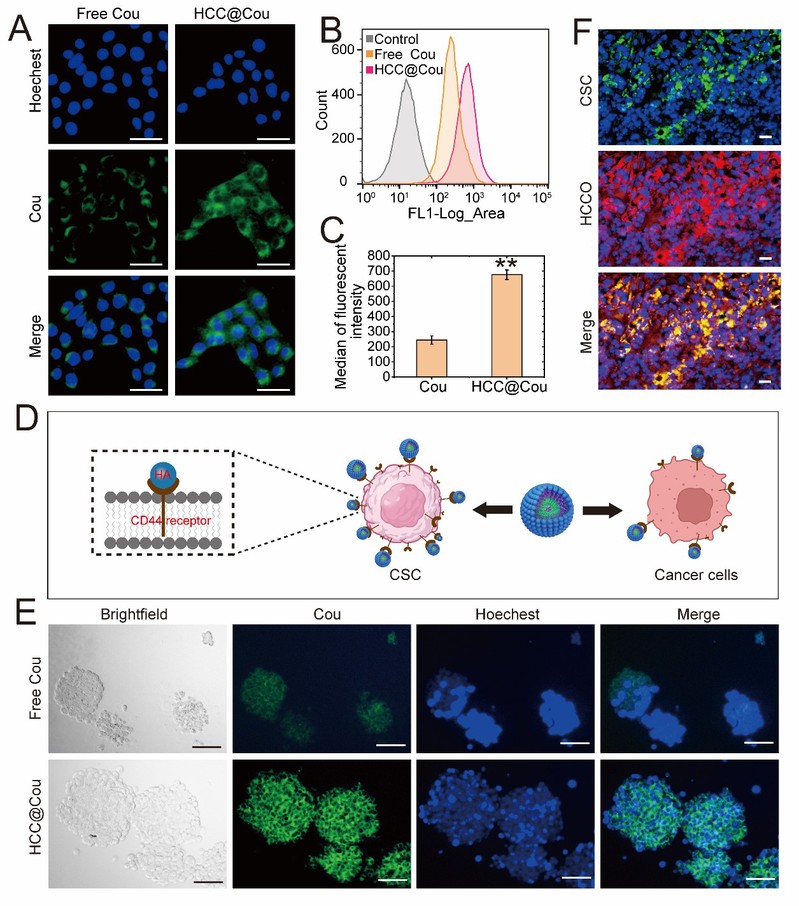
图2:HCCO在体外和体内对CSCs的靶向能力。A)Cou和HCC@Cou的体外4T1细胞摄取(比例尺:50 µm)。B)Cou和HCC@Cou的4T1细胞摄取流式。C)流式细胞术的定量分析。D)HCCO的CSC靶向能力示意图。E)Cou和HCC@Cou的体外4T1‐CSC摄取(比例尺:100 µm)。F)肿瘤组织中ALDH1和Ce6的免疫荧光图像(比例尺:20 µm)。所有数据均显示为平均值±标准差(n=3)*P<0.05、**P<0.01。
该团队建立了4T1-CSCs荷瘤模型来评估HCCO的体内抗肿瘤作用,治疗方案如图3A所示。HCCO加光照组(HCCO+L)显示出更强的细胞凋亡(图3B),这表明PDT和OLA联合增强了DNA的损伤。在治疗期间小鼠体重无明显变化(图3C),表明HCCO具有良好的安全性。
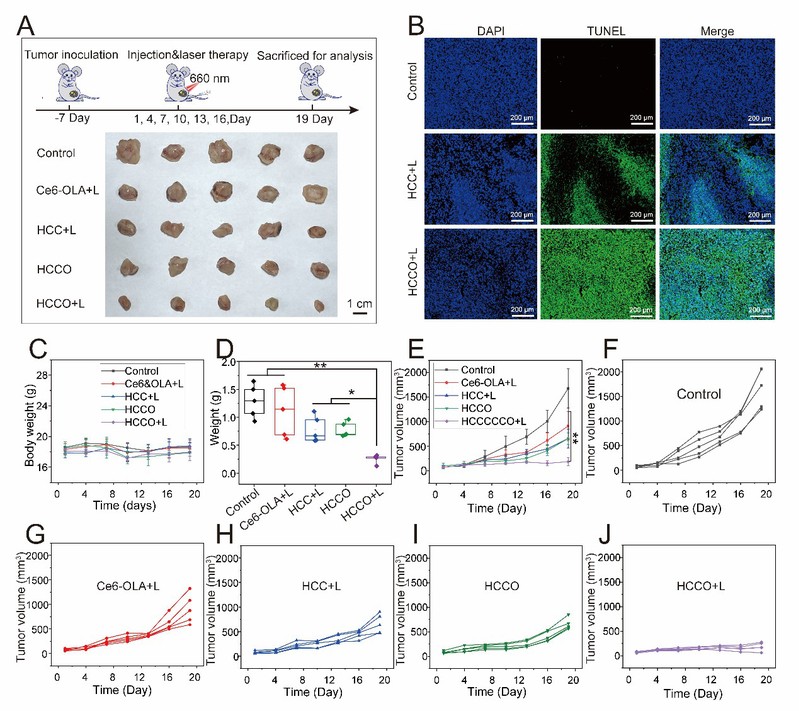
图3:对4T1‐CSC乳腺癌的体内抗肿瘤活性。A)CSC消除策略和肿瘤治疗后图像。B)治疗后19天肿瘤切片的TUNEL染色图像。凋亡细胞用绿色标记(比例尺:500 µm)。C)19天内用不同制剂治疗的小鼠的体重变化。D)治疗后的最终平均肿瘤重量。E)用不同制剂治疗的小鼠的肿瘤变化趋势。F–J)不同组的个体肿瘤生长曲线。所有数据均显示为平均值±标准差(n = 5)*P<0.05、**P<0.01。
手术切除是癌症治疗的常用方法,但由于肿瘤组织中存在肿瘤干细胞,往往无法抑制肿瘤复发,甚至诱导肿瘤转移。为了评估HCCO+L的抗复发效果,该课题建立了CSC肿瘤术后切除模型(图4A)。结果表明,HCCO+L治疗的肿瘤明显小于对照组,且明显抑制了肺转移结节(图4B-F),表明HCCO+L具有良好的抗肿瘤复发作用。
为进一步评价肺转移抑制效果,该团队在更具侵袭性的肺转移模型中评估了其抗肿瘤转移作用(图4G)。与其他组相比,HCCO+L组肺表面的转移灶显著减少(图4H-J),表明HCCO+L显著抑制了癌症的肺转移。

图4:体内抗肿瘤复发和肺转移。A)复发小鼠模型的治疗方案图解。B)治疗后的肿瘤图像。C)肺转移结节的照片(比例尺:0.5厘米)。转移结节用红圈标记。D)肿瘤体积生长曲线。E)最终平均肿瘤重量。F)每组肺转移结节的数量。G)肺转移模型的治疗方案示意图。H)治疗后肺部照片。I)肺组织的H&E图像。黑色箭头表示转移性结节。J)I中黑色方块的放大肺部图像,蓝色圆圈表示转移性结节。所有数据均显示为平均值±标准差(n = 5) *P<0.05,**P<0.01,***P<0.001。
该团队一方面,通过PDT和OLA的组合实现了不可逆的DNA损伤,克服了CSCs因强大的DNA损伤修复对治疗的耐药性,明显增强了PDT的抗肿瘤疗效;另一方面通过诱导增强的ICD效应和抑制MDSC浸润来逆转CSC抗性,有效抑制了癌症的复发和转移。该团队的研究为增强PDT的疗效和抗肿瘤转移和复发提供了新的策略。
尽管该研究中CSCs的治疗耐药性得到了显著逆转,但由于CSCs的多向分化特性,很难完全消除CSCs。在随后的研究中,可进一步将HCCO与分化剂(如全反式维甲酸)结合,将CSC诱导分化为正常肿瘤细胞后,再通过PDT和DNA损伤修复抑制相结合,可以更为彻底地消除CSC的耐药性和发挥抗肿瘤疗效。
原文链接:https://doi.org/10.1002/adhm.202302597
【关闭】





